Хондроциты из ИПСК восстанавливают хрящ без искусственной подложки
Для пожилых людей «скрип» и боль в суставах – скорее норма, чем исключение. Но иногда такое наблюдается и в молодом возрасте. Хотя эти боли редко угрожает жизни, они влияют на ее качество. Во многих случаях причиной является потеря гиалинового хряща, не обладающего способностью регенерировать, что означает, что, если он разрушен, то разрушен навсегда.
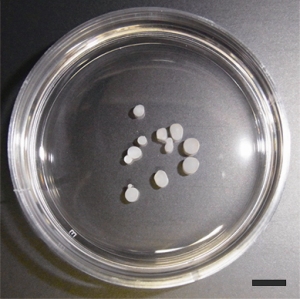 Частицы, содержащие хондроциты и секретируемые
Частицы, содержащие хондроциты и секретируемые
ими белки экстрацеллюлярного матрикса.
(Фото: Professor Noriyuki Tsumaki,
Kyoto University/Stem Cell Reports)
Гиалиновый хрящ состоит из хондроцитов и секретируемого ими экстрацеллюлярного (внеклеточного) матрикса (ЭЦМ) – белков, в число которых входят коллагены II и XI. В состав внеклеточного матрикса не входит коллаген I – основной коллаген волокнистого хряща, или рубцовой ткани. Следовательно, ключом к успешному восстановлению является введение в поврежденный хрящ хондроцитов, которые секретируют только белки ЭЦМ гиалинового хряща.
Одной из наиболее распространенных стратегий лечения гиалинового хряща является трансплантация аутологичных хондроцитов. Этот метод включает в себя получение гиалинового хряща посредством биопсии и последующую его трансплантацию в поврежденный участок. Так как размер полученного с помощью биопсии хряща меньше, чем площадь, которая нуждается в восстановлении, хондроциты нужно размножить – задача, требующая ферментативного расщепления белков ЭЦМ. К сожалению, размножение заставляет хондроциты секретировать коллаген I, почему появление фиброзной ткани после таких операций является неизбежным.
Таким образом, «хондроциты теряют хондрогенные свойства», поясняет профессор Нориюки Цумаки (Noriyuki Tsumaki) из Центра исследования и применения IPS-клеток (Center for iPS Cell Research and Application) Киотского университета (Kyoto University, KU).
Чтобы решить эту проблему, профессор Цумаки и его группа, в сотрудничестве с группой во главе с профессором Высшей школы медицины (KU Graduate School of Medicine) Шуичи Мацуда (Shuichi Matsuda), разработали новый протокол размножения клеток, но не хондроцитов, а индуцированных плюрипотентных стволовых клеток (ИПСК). После получения достаточного количества ИПСК их дифференцируют в хондроциты. Поскольку эти хондроциты получаются непосредственно из ИПСК, нет необходимости расщеплять белки ЭЦМ, что позволяет избежать появления фиброзной ткани и синтезировать только гиалиновый хрящ.
Еще одно преимущество этого метода состоит в том, что он позволяет избежать использования искусственных подложек. В других исследованиях по пересадке дифференцированных из эмбриональных и индуцированных плюрипотентных стволовых клеток хондроцитов в трансплантаты входят искусственные подложки, обеспечивающие структурную поддержку до тех пор, пока хондроциты не начнут секретировать свои собственные матриксные белки. Однако до сих пор неясно, не препятствуют ли искусственные материалы оптимальной интеграции трансплантата в хрящ. Поскольку хондроциты уже начали секретировать белки ЭЦМ, их можно пересаживать без подложек. Эта особенность объясняется использованием в течение шести недель культуральной суспензии и среды, включающей в себя Bmp2, TGF 1 и GDF5. По истечении этого времени хондроциты прекращают пролиферировать и начинают секретировать белки ЭЦМ гиалинового хряща высокой степени чистоты.
Эта смесь из хондроцитов и белков ЭЦМ забирается в виде частиц 1–2 мм в диаметре, которые можно непосредственно трансплантировать в поврежденную ткань. Каждая частица содержит приблизительно 70 тысяч хондроцитов. По мнению профессора Цумаки, это веская причина полагать, что можно получить достаточное для трансплантации количество человеческих клеток.
«Для устранения дефекта размером в 1 см2 необходим 1 миллион хондроцитов, а площадь типичного дефекта составляет 2–10 см2. Таким образом, мы рассчитываем на пересадку 30–150 частиц. Эти цифры вполне достижимы», – считает профессор Цумаки.
Исследователи уже пересадили свои частицы трем модельным животным (мышам, крысам и мини-пигам) и наблюдали положительные признаки как интеграции трансплантата, так и обновления хряща. Эти результаты вдохновляют профессора Цумаки.
«Это лишь предварительные результаты, но они демонстрируют хорошие показатели безопасности. Следующий шаг – до перехода к лечению пациентов – найти наилучшие условия для трансплантации большим животным», – говорит о своей работе и делится ближайшими планами японский ученый.
Оригинальная статья
Generation of Scaffoldless Hyaline Cartilaginous Tissue from Human iPSCs
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России