Неогенетика: кто займется программированием живых организмов?
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Любой организм – это реализация программ, зашифрованных в геноме. Гены не просто кодируют белки, они могут взаимодействовать между собой. В последнее время ученые активно занимаются не только расшифровкой генетических программ, но и написанием (а затем и внедрением в живые клетки) своих собственных.
Еще недавно о том, чтобы создавать клетки, выполняющие заложенные человеком программы, можно было только фантазировать, но на наших глазах это становится реальностью. Используя живую клетку как «болванку», ученые могут вкладывать в нее созданные ими алгоритмы (пока довольно простые).
В будущем запрограммированные клетки могли бы лечить неполадки в нашем теле, производить нужные нам вещества (лекарства, топливо).
Чтобы «перепрограммировать» клетку недостаточно добавить тот или иной ген («ген способности вырабатывать биотопливо»), нужно построить систему, в которую входят взаимодействующие друг с другом гены и их продукты – белки. Такие системы называются генными сетями.
Гены сплетаются в сеть
Ген – это участок ДНК, кодирующий один белок. Белки в клетке выполняют всю основную работу. В середине прошлого века ученые выяснили, что они также могут влиять на активность генов (под активностью гена понимается скорость синтеза с него белка: чем более он активен, тем больше с него синтезируется белка за единицу времени).
Для того чтобы белки могли управлять генами, в молекуле ДНК присутствуют особые регуляторные участки. Присоединение к ним белков приводит либо к увеличению, либо к уменьшению (вплоть до «выключения») активности некоторого гена. У одного гена может быть несколько регуляторных участков – своего рода рычагов управления, к которым могут присоединяться различные белки.
Зачем же нужно управлять активностью генов? Рассмотрим для начала относительно просто устроенные организмы – одноклеточных.
Зачем организмам генные сети?
У всех живых организмов за «переваривание» пищи отвечают особые белки – ферменты. Пусть некоторая группа ферментов служит для переваривания какого-то питательного вещества, например, лактозы – любимого лакомства некоторых бактерий. Время жизни фермента (его ресурс) ограничен, а производство новых белков требует затрат энергии. Поэтому, если в течении длительного времени данного питательного вещества в среде нет, то белки для его переваривания выгодней не производить.
Именно так и поступают бактерии. У них есть один управляющий ген, который включает или выключает гены, кодирующие белки, необходимые для расщепления лактозы. Активность этого управляющего гена зависит от наличия лактозы в среде. Получается, нечто вроде подпрограммы, которая запускается лишь тогда, когда она нужна.
В самом начале своей жизни каждый из нас был всего одной клеткой. Она многократно делилась, и в итоге из ее копий было построено наше тело. Генотипы всех клеток нашего организма одинаковы, ведь молекула ДНК копируется при делении очень точно. Возникает вопрос: почему же тогда сами клетки разные?
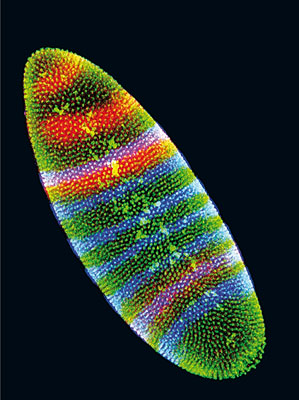 Рис. 1. Во время развития эмбриона мухи дрозофилы различные гены активируются в разных частях тела, благодаря чему они отличаются друг от друга.
Рис. 1. Во время развития эмбриона мухи дрозофилы различные гены активируются в разных частях тела, благодаря чему они отличаются друг от друга.
Объясняется это тем, что только небольшая часть генов внутри клеток находится в активном состоянии. В разных клетках набор «включенных» генов различен, а значит, в них будут синтезироваться разные белки, они будут работать по различным программам, то есть отличаться внутренне и внешне. «Судьба» клеток (какой стать нервной клеткой, а какой – мышечной) решается во время развития зародыша.
Генные сети внутри нас
Искусственные часы были изобретены человечеством около 4-х тысяч лет назад. Но природа придумала часовой механизм намного раньше – за миллиарды лет до этого. Даже в примитивных бактериях существуют процессы, ежесуточно отмеряющие время (они называются циркадными).
Есть такие внутренние биологические часы и внутри людей. Они позволяют организму находиться в оптимальном для данного времени суток состоянии и управляют циклом сон-бодрствование.
Основные часы находятся в одной из областей головного мозга – супрахиазматическом ядре. Генные сети, функционирующие в нейронах, меняют их состояние. Нервные клетки передают сигналы дальше, вызывая в нас желание спать ночью и бодрствовать днем, а также подстраивают работу внутренних органов. От сетчатки глаза в супрахиазматическое ядро идет пучок нервных волокон, что позволяет «подводить» часы под режим смены дня и ночи (поэтому мы можем постепенно втягиваться в правильный ритм после дальних перелетов в другие часовые пояса).
В начале XXI века ученые смогли разобраться, как именно работают такие часы. Было найдено более 50 «часовых» генов, на взаимодействии которых и построен этот механизм.
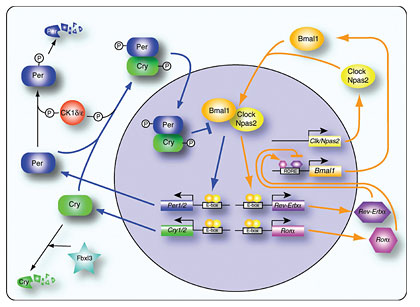 Рис. 2. Схема основных взаимодействий генов и белков внутренних часов.
Рис. 2. Схема основных взаимодействий генов и белков внутренних часов.
В этой сети существует две сигнальные цепочки, показанные оранжевыми и голубыми линиями. Они активируются друг другом поочередно, что можно сравнить с колебаниями маятника. Дополнительные элементы нужны для большей стабильности механизма в целом (вопреки случайностям молекулярных взаимодействий) и для «подводки» часов.
У большинства людей весь описанный цикл проходит за 24–25 часов, но при некоторых мутациях он может сильно отклоняться, что приводит к появлению «настоящих», ярко выраженных сов и жаворонков.
Расшифровка генных сетей
Выше – лишь несколько функций, выполняемых благодаря взаимодействию генов. На самом деле их гораздо больше. Это наиболее древний (из сохранившихся) метод управления в живых системах. Он отвечает за основные клеточные механизмы (рост, деление, переваривание или запасание питательных веществ). Генные сети можно сравнить с ассемблером – одним из наиболее низкоуровневых языков программирования для компьютеров.
Чтобы расшифровать генную сеть, нужно найти взаимодействующие гены и выяснить характер (торможение или активация) и силу их связи. На основе полученной информации можно строить компьютерные вычислительные модели, которые просчитывают эти взаимодействия. Этим занимаются молекулярные биологи и биоинформатики. У расшифровки генных сетей есть два главных практических применения: медицинское и технологическое.
Ряд заболеваний (особенно «возрастных») происходит из-за разлада механизмов взаимодействия генов. Генные сети активно используют вирусы, когда проникают в клетку хозяина. Для поиска средств борьбы с этими напастями фармакологические компании проводят огромное число опытов с вероятными претендентами на роль эффективного лекарства. Обладая моделью происходящих внутри клетки процессов, подобные опыты можно проводить не на лабораторных животных, а при помощи компьютерного моделирования, что и дешевле и быстрее. Подобные модели позволяют искать как потенциальные мишени для лекарств, так и лекарственные вещества, воздействующие на них. Это обеспечивает интерес (выражающийся в финансировании) медицинских компаний к расшифровке генных сетей.
Другим возможными практическим применением генных сетей является «программирование» живых клеток на выполнение нужных нам функций. Это может быть синтез лекарственных веществ (антибиотики и не только), биотоплива, кормов для животных и не только.
Синтетическая биология
В последнее десятилетие зародилась и становится все более популярной синтетическая биология. На протяжении веков биологи изучали организмы, созданные природой в ходе эволюции. Идея синтетической биологии в том, чтобы самим проектировать живые системы с нужными свойствами. Это нужно не только для практических задач, но и для фундаментального познания природы. Ведь единственный способ действительно понять что-то – научиться делать, конструировать.
В синтетической биологии существуют два основных направления. Первое – создание простейших живых систем «с нуля». Второе – внедрение в живую клетку искусственных геномов или их участков. Разница примерно такая же, как между созданием компьютера и написанием для него программы. Первое – еще не удается, а вот второе – вполне.
Первым успехом по внедрению искусственной генной сети стало создание Майклом Еловицом (Michael Elowitz) и Станисласом Лайблером (Stanislas Leibler) «Репрессилятора» (Repressilator), который заставлял бактерий «мигать» наподобие новогодней гирлянды. Схема его простая: три гена, последовательно тормозящие друг друга, и еще один, который вырабатывает светящийся белок.
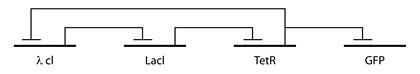 Рис. 3. Ген GFP вырабатывает светящийся белок, а остальные входят в «часовой механизм».
Рис. 3. Ген GFP вырабатывает светящийся белок, а остальные входят в «часовой механизм».
Компьютерное моделирование показывало, что подобная схема должна привести к периодическим колебаниям в активности генов. Это же показали и живые бактерии, которым были внедрены (при помощи плазмид, небольших участков ДНК, которые самостоятельно встраиваются в геном бактерий) нужные гены. Что любопытно, несмотря на то, что генная сеть «Репрессилятора» была для каждой бактерии одинакова, вели они себя немного по разному: активность генов у них менялась с разным периодом, а у некоторых и вовсе не наблюдалось колебаний. Это объясняет, зачем для создания естественных «внутренних часов» (которые работают, к счастью, гораздо надежнее «Репрессилятора») эволюции потребовалось не три гена, а несколько десятков: дополнительные контуры отрицательных и положительных связей повышают надежность системы.
В январе прошлого года в Nature была опубликована статья, в которой авторы (Джефф Хэсти (Jeff Hasty) и его коллеги описали создание и внедрение генной сети, обеспечивающей не только колебание уровня флюоресцентного белка, но и обмен сигналами между отдельными клетками, позволявший выполнять синхронизацию свечения между ними.
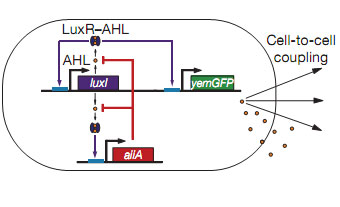 Рис. 4. Модель взаимодействия трех генов и результат ее работы.
Рис. 4. Модель взаимодействия трех генов и результат ее работы.
Вначале они разработали вычислительную модель подобной сети и проверили ее работоспособность на компьютере. Затем, при помощи вирусов, они встроили живым бактериям нужные гены, позаимствованные из двух видов других бактерий (наподобие того, как собирался монстр Франкенштейна) и наблюдали за поведением клеток. Бактерии вели себя очень схожим с предсказанным образом, постепенно переходя в синхронный режим колебаний.
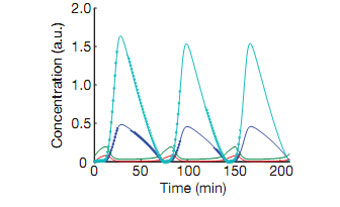 Рис. 5. Большими прямоугольниками показаны гены, маленькими – их регуляторные участки, два типа стрелок – активирующие и тормозящие связи.
Рис. 5. Большими прямоугольниками показаны гены, маленькими – их регуляторные участки, два типа стрелок – активирующие и тормозящие связи.
Создаются уже и применимые на практике разработки. Так биолог Дрю Энди (Drew Endy) из MIT занимается созданием биодетектора скрытых мин. В бактерии внедряется несколько взаимодействующих генов, которые кодируют белки-рецепторы (активизирующиеся тротилом) и сказанные с ними флюоресцентные белки. Затем микроорганизмы распыляются на местности. Там, где есть тротил в почве (а он неизбежно просачивается из мины наружу), бактерии синтезируют флуоресцентный белок, после чего в темное время суток мины можно обнаружить по свечению, которое испускается микробами.
Пусть меня научат
В России биоинформатикой занимаются в лабораториях Михаила Гельфанда (Институт проблем передачи информации) и Вадима Говоруна (Институт биоорганической химии).
Находят там свое место люди различных специальностей: и биологи, и физики, и математики, и программисты.
Автор: Манолов Александр, Институт Высшей Нервной Деятельности и Нейрофизиологии РАН, аспирант.
- Источник(и):
-
1. CNews
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России