Новая мишень для антибактериальных препаратов
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Исследовательской группой под руководством ученых из Университета Аризоны (University of Arizona) детально изучен молекулярный механизм, используемый бактериями для выведения токсичных веществ, включая антибактериальные лекарственные препараты. Более глубокое понимание таких механизмов поможет в разработке новых средств борьбы с патогенными микроорганизмами.
Микробы колонизировали практически всю нашу планету – от глубоководных источников, извергающих содержащую тяжелые металлы морскую воду, до ледяных вершин самых высоких горных хребтов.
Частично их способность процветать в самых суровых условиях основывается на сложных молекулярных механизмах взаимодействия с веществами, необходимыми для протекающих в клетках биологических процессов, но опасными при накоплении в более высоких концентрациях.
«Медь – обоюдоострый меч для организмов, так как это жизненно важный компонент некоторых ферментов, необходимых для осуществления метаболических функций, но слишком большое ее количество оказывает токсическое воздействие и может убить клетку», – говорит Кристофер Ренсинг (Christopher Rensing), доцент кафедры почвы, воды и экологии Колледжа сельского хозяйства и наук о жизни Университета Аризоны.
Тонкий баланс поддерживается специализированными белками-переносчиками, встроенными в мембраны клеток, которые выполняют функцию «чистильщиков», собирая токсины, такие как ионы металлов, и выкачивая их из клетки.
Исследование, проведенное в лаборатории Ренсинга, сфокусировано на взаимодействии микробных клеток с такими металлами, как медь и серебро, и на разработке новых способов использования металлов для борьбы с микробами.
Ученые давно восхищаются сложностью белков-транспортеров и отточенностью их способности распознавать химические вещества и предпринимать соответствующие меры. Однако многие из этих механизмов остаются нерасшифрованными.
Изучив в мельчайших подробностях класс клеточных белков-транспортеров, известных как RND-белки, группа исследователей под руководством ученых из Университета Аризоны Юн-Хэ Ким (Eun-Hae Kim), Меган Мак-Эвой (Megan McEvoy) и Кристофера Ренсинга (Christopher Rensing) по-новому взглянула на осуществление этими белками их функций. Основываясь на результатах исследования, опубликованного в последнем номере журнала Journal of Bacteriology, Ким и ее коллеги предложили новую рабочую модель белков-транспортеров, способную оказать большое влияние на разработку антибактериальных средств.
«Если вы микроб, перед вами встает вопрос, как избавиться от лишней меди и при этом сохранить достаточное ее количество для поддержания основных жизненных процессов», – комментирует работу Ренсинг. «Мы хотели выяснить, как микробы оценивают концентрацию меди внутри клетки и регулируют в зависимости от нее насосную функцию белков-транспортеров».
Изменяя части белков-переносчиков и анализируя результаты, докторант Ренсинга Юн-Хэ Ким обнаружила, что ее данные противоречат общепризнанной гипотезе о том, как работает эта белковая транспортная система.
 Докторант и ведущий автор исследования
Докторант и ведущий автор исследования
Юн-Хэ Ким (Eun-Hae Kim) проверяет колбу
с растущими в жидкой среде бактериями.
(Фото: Beatriz Verdugo/UANews)
Белковый насос состоит из нескольких отдельных строительных блоков, которые вместе составляют функциональную единицу. Его главные компоненты – два белка, встроенные в оба мембранных слоя, окружающих бактериальную клетку. Третий белок, называемый мембранным белком слияния, функционирует в качестве мостика, соединяющего мембранные белки. Весь комплекс образует туннель, который, открываясь, соединяет внутреннюю среду клетки с внешним миром.
«Ученых всегда интересовало, какова функция этого мембранного белка слияния», – говорит Ким. «Мы знали, что кроме обеспечения механической связи он принимает активное участие в самом процессе выкачивания ионов, но никто не знал, как».
Группа Ким предположила, что вместо связывания ионов меди по одному и передачи их от одного белкового компонента к следующему перед тем, как вытолкнуть из туннеля, мембранный белок слияния функционирует как выключатель, приводящий в действие молекулярный насосный механизм. Поэтому они назвали свою гипотезу «моделью выключателя».
«После активации форма мембранного белка слияния претерпевает изменение», – объясняет Ким. «Это включает другие компоненты комплекса белка-транспортера. Предыдущие исследования показали, что до начала выкачивания ионов меди из клетки он может раскрываться, как цветок ириса».
Исследование Ким показало, что, кроме приведения процесса в движение, мембранный белок слияния функционирует в качестве датчика.
«Он имеет шесть сайтов связывания с медью», – объясняет она. «Только если в клетке достаточно меди для насыщения всех шести, белок приводится в действие».
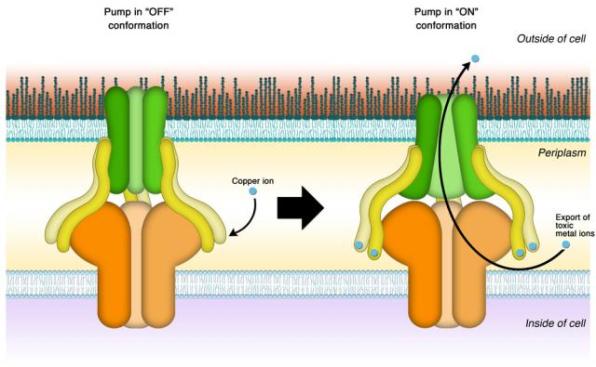 Модель белкового насоса: пронизывающие окружающую бактериальную клетку мембрану три типа белков составляют
Модель белкового насоса: пронизывающие окружающую бактериальную клетку мембрану три типа белков составляют
насос, показанный зеленым, желтым и оранжевым. Ким и ее коллеги установили, что мембранный белок
слияния (желтый) не только соединяет две внешние части комплекса, но и функционирует в качестве сенсора и выключателя. Когда с белком связывается достаточное количество ионов (синие), насос включается и
выталкивает ионы из клетки. (Иллюстрация Eun-Hae Kim)
Экспериментальная система, разработанная группой Ренсинга, служит моделью для изучения и других наносных белков, а не только переносчиков меди. Аналогичные молекулы позволяют бактериям удалять антибиотики, а раковым клеткам – химиотерапевтические препараты.
Понимание точного молекулярного устройства насосных белков микробов и клеток в целом имеет далеко идущие последствия, охватывающие глобальный климат, рак, нейродегенеративные заболевания, такие как болезни Альцгеймера и Паркинсона, процесс старения и антибиотики, считает Ренсинг.
«Если компоненты известны, можно разработать препараты, для которых эти компоненты будут являться мишенями. Такие препараты будут убивать только те бактерии, в которых присутствуют такие компоненты, что сведет к минимуму побочные эффекты».
«Наша модель позволяет нам анализировать в деталях, как работает насос, что делает возможным разработку его ингибиторов», – добавляет Ким.
Насосы-переносчики меди используются и макрофагами, или белыми клетками крови. Это первая линия защиты иммунной системы от патогенных микроорганизмов.
«Макрофаги захватывают ионы меди в зонах воспаления, чтобы создать химическую среду, благоприятную для формирования реактивных молекул кислорода», – объясняет Ренсинг. «Эти реактивные молекулы кислорода вместе c ионами меди затем убивают микробы».
Со своей стороны микробы развили молекулы-переносчики, удаляющие токсичную медь, чтобы помочь себе предотвратить такие атаки.
«Если бы нам удалось заблокировать их переносчики, мы создали бы Ахиллесову пяту, сделав их уязвимыми для меди, используемой против них макрофагами».
До того, как стали доступными антибиотики, многие антимикробные средства были основаны на металлах.
«Серебро в очень малых количествах подавляет некоторые ферменты бактерий», – говорит Ренсинг. «Вот почему некоторые из таких препаратов назывались «серебряными» или «волшебными пулями». Учитывая, что все больше и больше микробов становятся устойчивыми к антибиотикам, понимание и использование молекулярных насосов в качестве мишеней лекарственных препаратов становится все более важным».
Группа Ренсинга обнаружила белковые переносчики RND-типа в мембранах бактерий, живущих в экстремальных условиях, таких как марганцевые конкреции на глубоких подводных равнинах. Как установили ученые Института океанографии Скриппса (Scripps Institution of Oceanography) в Сан-Диего белки-переносчики ионов металлов используют даже бактерии, живущие глубоко в океане, но гораздо выше океанского дна.
«Мы были удивлены, обнаружив, что они нагружены такими транспортерами», – говорит Ренсинг. «Для чего они их используют? Никто не знает, но, очевидно, для них важна способность очень точно регулировать концентрацию меди. Металлы и их доступность для микробов оказывают громадное влияние на глобальные циклы, в том числе на климат. Изучение роли, которую металлы играют в таких процессах, и то, как бактерии переносят их в и из своих клеток – новый рубеж науки».
Аннотация к статье Switch or Funnel: How RND-Type Transport Systems Control Periplasmic Metal Homeostasis
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России