Разработан новый метод определения структуры белков
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Ученые из Массачусетского технологического института (Massachusetts institute of technology) разработали метод анализа структуры белков, не требующий их предварительной обработки и впервые позволяющий наблюдать изменение их конформации, происходящее в течение пикосекунд, или триллионных долей секунды.
Белки могут принимать различные формы, и знание этих форм помогает в определении их функции. Анализ структуры белка может многое рассказать ученым о поведении молекулы, но многие из используемых в настоящее время методов ее расшифровки требуют кристаллизации белка или какого-либо другого изменения его естественного состояния.
Ученые во главе с профессором химии Андреем Токмаковым (Andrei Tokmakoff) и постдокторантом Карлосом Байзом (Carlos Baiz) описали свой новой метод в статье, опубликованной в журнале Analyst. Их подход основан на технологии, известной как двумерная инфракрасная спектроскопия, то есть на облучении молекул импульсами инфракрасного света и количественной оценке возникающих в результате облучения молекулярных колебаний. Ученые разработали метод анализа данных и определения их корреляции со структурными элементами белков.
После образования первичной структуры белки, как правило, сворачиваются в одну из двух вторичных структур – альфа-спирали и бета-складчатые листы. Американские ученые проводят различие между этими двумя структурами, исследуя, как под воздействием инфракрасного света изменяются связи между углеродом и кислородом, присутствующие в каждой из аминокислот, входящих в состав белков.
В альфа-спирали связи между углеродом и кислородом параллельны остову белка; в бета-листе эти связи перпендикулярны листу. Из-за этой разницы при ударе инфракрасным излучением связи колеблются на разных частотах, что позволяет вычислить процент аминокислот, входящих в спиральную структуру, и процент аминокислот, образующих бета-лист.
Исследователи подтвердили правильность своих расчетов, проанализировав белки, структуры которых уже известны. Пока метод не раскрывают точную структуру белковой молекулы, но ученые работают над способами определения организации листов и спиралей, исходя из спектроскопических данных.
«В принципе, в спектре белка представлена его полная структура. Вопрос в том, как извлечь эту информации», – говорит доктор Байз, ведущий автор статьи.
Один из способов решить эту задачу – анализ данных, получаемых от более широкого спектра инфракрасных волн. Кроме того, ученые разрабатывают методы получения информации о других связях внутри аминокислот.
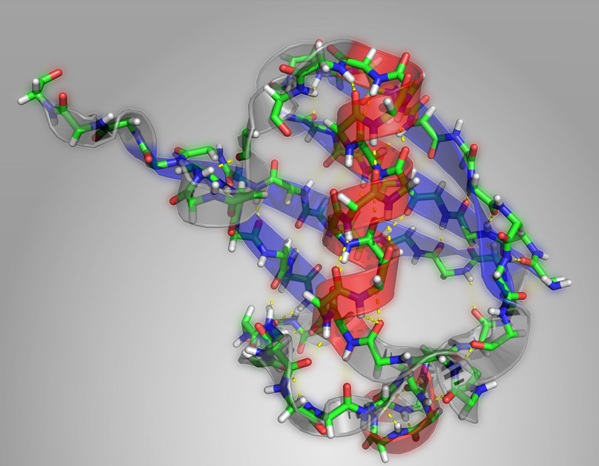 Структура белка убиквитина. Альфа-спирали показаны красным, бета-листы – синим. (Фото: Carlos Baiz)
Структура белка убиквитина. Альфа-спирали показаны красным, бета-листы – синим. (Фото: Carlos Baiz)
Так как новый метод позволяет получать результаты за миллионные доли секунды, он может быть использован для изучения сворачивания и разворачивания белков при их тепловой денатурации. Нагрев белок с помощью лазера, можно получить серию снимков, отображающих процесс его разворачивания, занимающий очень короткий промежуток времени.
Обычно ученые изучают две статичные белковые структуры – одну, когда белок еще находится в несвернутом состоянии, и вторую, когда он уже полностью свернут.
«Это первый метод, который позволяет делать снимки структуры белка в процессе его денатурации», – говорит Байз. «То, что мы можем делать теперь, это наблюдать за всеми конформационными изменениями в процессе их развития».
Как сворачивается белок – сложнейший вопрос. В какой момент молекула переходит от полностью неупорядоченной к упорядоченной структуре? Не принимавший участия в этой работе доцент кафедры химии Университета Вашингтона (University of Washington) Мунира Халил (Munira Khalil) считает, что самой сильной стороной нового метода является возможность отслеживать структурные изменения в динамике.
Этот метод может оказаться особенно полезным при изучении белков, неправильное сворачивание которых приводит к развитию заболеваний. Здесь можно назвать тау-белок, связываемый учеными с болезнью Альцгеймера, и прионы, вызывающие болезнь Кройтцфельдта-Якоба.
Кроме того, он может использоваться для определения структурных изменений, происходящих при взаимодействии белковых молекул.
«Если белок, как скала, не изменяет свою структуру, он никогда не свяжет свою мишень и вообще не сможет ничего сделать. Вот те типы процессов, которые мы можем изучать – конформационные изменения, управляющие биологическими функциями», – подводит итог доктор Байз.
Аннотация к статье
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России