Как и зачем биологи вырастили «в пробирке» миниатюрный человеческий мозг?
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Австрийские ученые впервые вырастили из стволовых клеток миниатюрное подобие человеческого мозга. Строго говоря, то, что у них получилось, полноценным мозгом назвать нельзя. Однако этот «церебральный органоид», как прозвали его авторы, обладает многими свойствами своего прототипа: в нем есть разные отделы, его нейроны взаимодействуют между собой и формируют функциональные группы, в процессе его роста в биореакторе происходит характерная для нормального развития миграция нейронов. Как этого удалось достичь и зачем ученым вообще понадобилось выращивать мозг в пробирке, разбиралась «Лента.ру».
Даже если отбросить вопросы этики и представить, что в мозге есть изолированные фрагменты, которые имеет смысл пересаживать некоторым больным, такая трансплантация представляется делом крайне отдаленного будущего. Дело в том, что мозг отличается от всех остальных органов своей уникальной сложностью. Ученые до сих пор не понимают, как в общем случае образуются функциональные группы нейронов при выполнении тех или иных задач. Поэтому неясно, как следует соединять нервные волокна при пересадке даже небольшого участка мозга. В 2009 году Национальные институты здоровья США создали проект «Коннектом человека», в рамках которого исследователи надеются составить полную трехмерную карту связей между нейронами. Количество этих связей, кстати, оценивают в квадриллион 1015 штук . Другой проект — Blue Brain — был основан Евросоюзом в 2013 году. Проект сфокусирован на анализе активности нейронов и создании «виртуального мозга» с помощью компьютерного моделирования взаимодействия отдельных нервных клеток и их групп.
Органы на вырост
Важность исследований по созданию искусственных органов очевидна. Искусственные органы при трансплантации имеют значительные преимущества над обычными донорскими.
- Во-первых, для их создания можно использовать собственный клеточный материал пациента, что позволяет избежать отторжения.
- Во-вторых, искусственные органы для каждого конкретного человека можно выращивать сразу, не дожидаясь появления подходящего донора.
За последние несколько лет эти исследования развились в целую область, в которой даже обозначились два направления. Одни ученые для создания искусственных органов используют технику децеллюляризации, при которой донорские органы очищаются от клеток, а оставшийся бесклеточный матрикс заселяется новыми, полученными из разрушенных тканей или из стволовых клеток реципиента. Другие исследователи пытаются использовать стволовые клетки сами по себе и создавать искусственные органы буквально «с нуля».
Стволовыми называют клетки разных типов, которые объединены тем, что могут дифференцироваться во множество различных зрелых клеток организма. Из таких клеток состоит эмбрион на ранней стадии развития, но со временем их доля в организме падает. Впрочем, уже сегодня ученые умеют получать стволовые клетки из дифференцированных зрелых клеток организма, активируя в них определенные гены раннего развития. Делается это либо при помощи введения специальных генетических конструкций, либо, как было недавно показано, даже без них — с помощью химической активации. Такие искусственно полученные стволовые клетки называют индуцированными плюрипотентными клетками (iPS). Как и обычные эмбриональные стволовые клетки, они могут превращаться практически в любую клетку организма (то есть обладают свойством плюрипотентности) — для этого нужно только подобрать необходимые условия.
Используя как индуцированные, так и эмбриональные стволовые клетки, ученые сегодня создают все более сложные органы.
В последние годы был создан искусственный мочевой пузырь, который даже удалось использовать для трансплантации, а также почка и печень. Кроме того, совсем недавно удалось вырастить искусственное сердце на основе бесклеточного матрикса мыши и индуцированных стволовых клеток человека.
Культурные нейроны
Но можно ли с помощью стволовых клеток создать нервную ткань или даже мозг? С точки зрения нужд трансплантации это совершенно бессмысленно: вы же не хотите, чтобы вам пересадили чужой мозг? Однако же само по себе это безумно интересно. Насколько фантастически сложная структура нервной ткани определяется внутренними свойствами клеток? В какой степени мозг формируется самостоятельно — в отрыве от остального организма?
В 2008 году исследователи из Бельгии и Франции обнаружили, что эмбриональные стволовые клетки мыши, культивируемые in vitro, способны воспроизводить основные этапы развития коры головного мозга. Клетки, помещенные в чашку Петри со специальной средой, образовывали последовательные популяции нейронов, которые при развитии настоящего мозга слой за слоем формируют кору. Сначала формировались нейроэпителиальные клетки-предшественники — недифференцированные клетки, которые в процессе эмбрионального развития дают начало нервной системе. Затем из них образовывались астроциты (вспомогательные клетки, «обслуживающие» нейроны) и пирамидальные клетки (основные нейроны коры головного мозга). Пирамидальные клетки, в свою очередь, дифференцировались на различные подтипы корковых нейронов — причем порядок появления разных клеточных популяций соответствовал тому, что наблюдается во время развития настоящего мозга.
В том же году японские ученые показали, что полученные из эмбриональных стволовых клеток нейроны способны формировать концентрические слои, которые демонстрируют свойства различных слоев и регионов коры головного мозга. Порядок появления разных популяций нервных клеток здесь также соответствовал тому, что наблюдается in vivo: из нейроэпителиальных клеток формировались корковые нейроны, которые затем дифференцировались на различные подтипы.
В этом исследовании, в отличие от предыдущего, авторы дополнительно показали, как можно управлять ростом нейронов на чашках, добавляя те или иные факторы роста — соединения, при помощи которых различные клетки «разговаривают» друг с другом на химическом уровне. Оказалось, что путем добавления разных факторов роста можно произвольно менять региональную идентичность нейронов. Кроме того, исследователи смогли, замедляя или ускоряя дифференцировки клеток, избирательно получать различные слои коры.
Наконец, в последние два года было показано, что из эмбриональных стволовых клеток может формироваться полноценный глазной бокал (вырост мозга эмбриона, из которого образуется сетчатка глаза) и даже сетчатка с высокоорганизованной слоистой структурой.
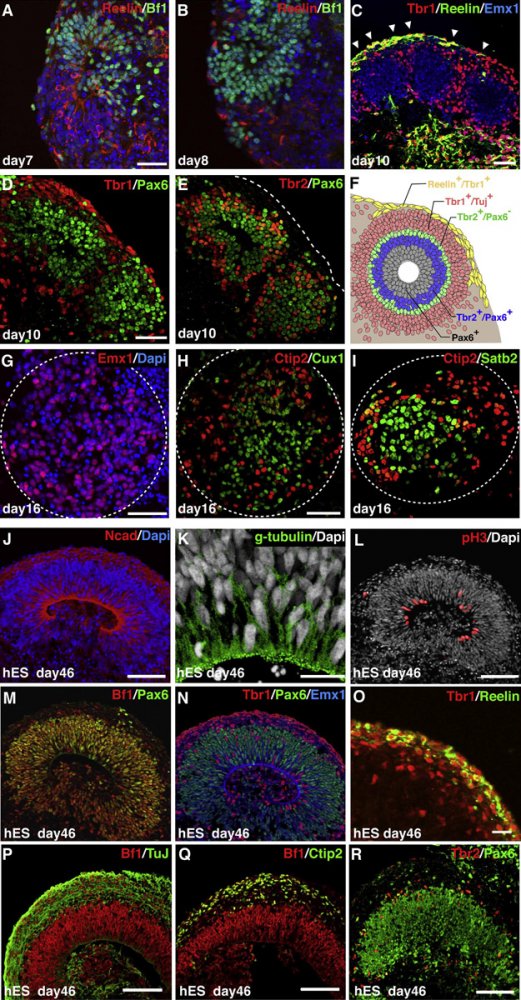 Рис. 1. Самоорганизация слоев корковых нейронов, окрашенных флюоресцентными антителами Eiraku et al., Cell, 2008.
Рис. 1. Самоорганизация слоев корковых нейронов, окрашенных флюоресцентными антителами Eiraku et al., Cell, 2008.
Что нового?
В недавнем исследовании ученым наконец-то удалось создать из стволовых клеток не кусочек нервной ткани, а целую модель эмбрионального мозга. Ученые из Института молекулярных биотехнологий Австрийской академии наук (IMBA) показали, что полученные из стволовых клеток нейроны при помещении их в подходящие условия самоорганизуются и образуют подобие мозга человеческого эмбриона.
Миниатюрному мозгу дали название «церебрального органоида» — потому что назвать его полноценным органом все-таки нельзя.
Для создания «мини-мозга» авторы использовали два типа стволовых клеток: и обычные эмбриональные, и индуцированные, полученные путем перепрограммирования фибробластов кожи. Клетки помещали в специальную среду, которая содержала необходимые питательные вещества и факторы роста. Из обоих типов клеток образовались сгустки нейроэпителиальной ткани. Их переносили в капли питательного синтетического геля, который заменял клеткам внеклеточный матрикс. Внеклеточный матрикс — это структура, состоящая в основном из белков и выполняющая «архитектурную» и транспортную роль во всех тканях и органах. Он определяет пространственные свойства ткани, участвует в миграции клеток, а также содержит иммобилизованные факторы роста, которые способны стимулировать клеточную дифференциацию «на местах». Именно такие структуры используются для создания искусственных органов на основе бесклеточного матрикса, о которых уже говорилось выше.
Затем капли геля c клетками переносили в биореактор — фактически просто вращающийся стерильный сосуд с управляемыми температурой и газовым составом. Там клетки в течение нескольких недель созревали и дифференцировались.
 Рис. 2. Развитие органоида, полученного из клеток здорового человека (сверху) и человека с микроцефалией (снизу). Изображение: Madeline A. Lancaster et al., Nature, 2013.
Рис. 2. Развитие органоида, полученного из клеток здорового человека (сверху) и человека с микроцефалией (снизу). Изображение: Madeline A. Lancaster et al., Nature, 2013.
Примерно через две недели в биореакторе появлялись первые «церебральные органоиды» диаметром от двух до четырех миллиметров. Внешне они не были похожи на маленький мозг, но их внутреннее устройство было удивительно схоже с натуральным прототипом.
- Во-первых, внутри органоидов появлялась полость, аналогичная мозговым желудочкам.
- Во-вторых, разные зоны органоида соответствовали разным отделам головного мозга: заднему, среднему и переднему, а «передний мозг» даже демонстрировал дальнейшую дифференциацию на доли — это удалось показать с помощью меченых флюоресцентными маркерами антител к специфическим антигенам разных типов клеток.
По мере развития органоида суммарное количество клеток, характерных для переднего отдела мозга, увеличивалось, а заднего — уменьшалось. Именно так и происходит при формировании мозга in vivo. Нервная ткань дифференцировалась на слои, соответствующие мозговой оболочке, гиппокампу, коре, сетчатке глаза и сосудистому сплетению (структуре, которая в желудочках мозга вырабатывает спинномозговую жидкость).
В слое, соответствующем коре головного мозга, происходила дальнейшая дифференциация. Клетки радиальной глии, образующиеся из исходных клеток, формировали вентрикулярную и прилежащую к ней субвентрикулярную зоны (обе они служат основным источником новых нейронов при развитии мозга). Субвентрикулярная зона, в свою очередь, разделялась на внешний и внутренний слои — дифференциация, характерная только для человека. В дальнейшем клетки радиальной глии тоже дифференцировались и даже мигрировали из внутренних областей органоида наружу, образуя внешние слои нейронов коры. Эти нейроны, созревая, формировали взаимодействующие между собой аксоны и демонстрировали кальциевые осцилляции, которые служат признаком активности — выросший из стволовых клеток «мини-мозг» начинал работать!
О пользе мозга
Авторам работы, однако, показалось недостаточным просто продемонстрировать то, насколько далеко может зайти развитие мозга без участия других частей организма. Чтобы показать, как получившийся органоид можно использовать в практических целях, ученые решили вырастить мини-мозг из клеток пациента с микроцефалией.
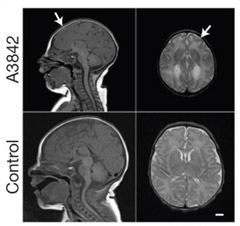 Рис. 3. МРТ головного мозга новорожденного
Рис. 3. МРТ головного мозга новорожденного
с микроцефалией (сверху) и здорового мозга (снизу).
Микроцефалия — это заболевание, которое характеризуется значительным уменьшением размера головного мозга и сопровождается умственной отсталостью. Чтобы понять ее этиологию, нужно иметь экспериментальную модель, но на мышах создать полноценную модель микроцефалии до сих пор не удавалось. Причина этого, во-первых, в том, что мозг у грызунов значительно меньше, чем у человека, и гораздо проще устроен: кора больших полушарий у них не имеет борозд и извилин. Во-вторых, мозг человека и мыши по-разному развивается — показано, что у грызунов нервные клетки-предшественники в вентрикулярной и субвентрикулярной зонах делятся и мигрируют далеко не так активно, как это происходит у человека. При этом они дают начало меньшему количеству слоев коры мозга.
Для того чтобы смоделировать развитие микроцефалии, исследователи вместо здоровых индуцированных стволовых клеток взяли клетки, полученные из фибробластов кожи человека с генетической формой микроцефалии. Органоиды, выращенные из таких клеток, оказались значительно меньше, чем контрольные. Участки собственно нервной ткани в таких органоидах были совсем небольшими по сравнению с контролем и содержали пониженное количество клеток радиальной глии. Число полностью дифференцированных нейронов, напротив, было повышенным. Это, как заключили авторы, указывает, что аномалия связана с ускоренным созреванием нервных клеток: клетки-предшественники созревают слишком рано и перестают давать новые нейроны, что приводит к остановке роста мозга. Становится понятно также, почему на мышах модель микроцефалии не работает: из-за более «пассивного» поведения клеток-предшественников уменьшение их популяции не дает такого сильного эффекта, как у человека.
 Рис. 4. Схема развития неокортекса грызунов (слева) и человека (справа). Jan H, Lui et al., Cell, 2011.
Рис. 4. Схема развития неокортекса грызунов (слева) и человека (справа). Jan H, Lui et al., Cell, 2011.
Не все так просто
Полученные результаты, конечно, не следует переоценивать: церебральный органоид довольно далек от полноценного мозга. Нетрудно понять почему: настоящий мозг у эмбриона развивается под влиянием не только внутренней программы, но и под воздействием сигналов от других частей организма, которых в биореакторе нет. Возможно, именно из-за этого аналоги разных отделов мозга в органоидах были расположены случайным образом и имели неправильную форму. Кора органоида, хотя и демонстрировала характерную слоистость, была устроена далеко не так сложно, как настоящая. И, конечно, не менее важно, что миниатюрный мозг не содержал кровеносных сосудов — из-за этого находящиеся в глубине клетки страдали от недостатка кислорода и питательных веществ. Максимальный размер полученных органоидов составлял всего 3–4 миллиметра — и даже при этом внутри них неизбежно появлялась зона мертвых клеток.
Теоретически проблема недостаточности кровоснабжения вполне решаема. Так, недавно японским исследователям удалось создать искусственную печень из индуцированных стволовых клеток человека. Из этих клеток ученые получили не только гепатоциты, но и клетки кровеносных сосудов и соединительной ткани — то есть все необходимые для печени элементы. В случае искусственных органов на основе бесклеточного матрикса, например, все сложнее. Дело в том, что при получении матрикса эпителиальные клетки, из которых состоят капилляры, удаляются вместе со всеми остальными клетками и практически не восстанавливаются при заселении органа новыми клетками. Как обойти эту проблему, ученые пока не придумали.
У методов создания искусственных органов из индуцированных стволовых клеток есть и другие подводные камни. Недавние исследования показали, что такие клетки чаще других перерождаются в опухолевые, и для использования искусственных органов на практике необходимо сначала понять, почему это происходит и как с этим бороться.
Однако, несмотря на все эти ограничения, исследовательская ценность выращенного in vitro мозга, безусловно, огромна. Уже сейчас церебральные органоиды можно использовать для изучения специфичных для человека процессов развития — в тех случаях, когда «мышиные» модели не могут предоставить необходимых сведений. Кроме того, такие органоиды могут быть полезны для тестирования лекарств.
Но будем честны, дело ведь не только в этом. Мозг в биореакторе — это еще и безумно красиво.
Автиор: Софья Долотовская.
- Источник(и):
-
1. lenta.ru
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России