5 загадок, касающихся происхождения CRISPR
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Франциско Мохика был не первым, кто увидел CRISPR, но, вероятно, первым ему удивился. Он помнит тот день в 1992 году, когда впервые взглянул на микробную иммунную систему, которая могла запустить биотехнологическую революцию. Он рассматривал данные последовательности генома солелюбивого микроба Haloferax mediterranei и заметил 14 необычных последовательностей ДНК, каждая длиной 30 оснований. Они повторялись через каждые 35 оснований или около того. Вскоре он нашел еще больше таких. Мохика был очарован и повторил свой фокус в исследовании в Университете Аликанте в Испании.
Его мало кто поддержал. Лаборатория годами работала без финансирования. На встречах Мохика пытался поймать за рукав крупнейшие имена и спросить у них, что те думают о странных маленьких повторах.
«Да не волнуйтесь вы так о повторах», отвечали они. «У многих организмов есть много повторов — мы знаем о них уже давно, только не знаем, как работают многие из них».
Сегодня о коротких палиндромных повторах, регулярно расположенных группами (CRISPR), известно намного больше, и именно они помогают микробной иммунной системе CRISPR-Cas уничтожать вторгающихся вирусов. И хотя большинство в биомедицине признали механику системы — отчасти из-за версии CRISPR-Cas9, которая используется для редактирования генов, — Мохика и другие микробиологи до сих пор не могут ответить на простые вопросы о системе и о том, как она работает. Как она развивалась, как повлияла на микробную эволюцию? Почему некоторые микробы используют ее, а другие нет? Могут ли у нее быть другие, пока не признанные роли в фундаментальной биологии?
«В СМИ уделяют много внимания системам CRISPR, благодаря использованию ее в качестве технологии — и не без оснований. Мы видим здесь огромное влияние и возможности», говорит Дженнифер Дудна, молекулярный биолог из Университета Калифорнии в Беркли, один из первых ученых, раскрывших возможность CRISPR-Cas в качестве инструмента редактирования генома. «В то же время есть много интересных исследований в области фундаментальной биологии, которые еще предстоит сделать».
Откуда он взялся?
Биологические преимущества чего-то вроде CRISPR-Cas очевидны. Прокариоты — бактерии и менее известные одноклеточные организмы под названием археи, многие из которых живут в экстремальных условиях, постоянно сталкиваются с натиском генетических захватчиков. Вирусы численно превосходят эукариот в десять раз и убивают половину бактерий мира через каждые два дня. Прокариоты также обмениваются частичками ДНК, плазмидами, которые могут быть паразитарными — они высасывают ресурсы из своего носителя и заставляют его самоуничтожиться, если тот попытается изгнать молекулярного попутчик. Кажется, безопасности нет нигде: от суши до моря и самых негостеприимных мест нашей планеты, генетические вторженцы есть повсюду.
Прокариоты эволюционировали и обзавелись оружием, чтобы справляться с этими угрозами. Ферменты рестрикции, например, представляют собой белки, которые разрезают ДНК при или около определенной последовательности. Каждый фермент запрограммирован распознавать определенные последовательности, и микроб защищен только если у него есть копия нужного гена. CRISPR-Cas намного более динамичный. Он адаптируется и запоминает определенных генетических вторженцев так же, как антитела человека обеспечивают долгосрочный иммунитет после инфекции.
«Когда мы впервые услышали об этой гипотезе, мы подумали, что это должно быть слишком сложно для простых прокариот», говорит микробиолог Джон ван дер Оост из Университета Вагенинген в Нидерландах.
Мохика и другие вывели функцию CRISPR-Cas, когда увидели, что ДНК в пространствах между палиндромными повторами CRISPR иногда соответствует последовательностям в вирусных геномах. С тех пор ученые выяснили, что определенные CRISPR-ассоциированные (Cas) белки добавляют эти пространственные последовательности (спейсеры) к геному после того, как бактерии и археи подвергаются воздействию определенных вирусов или плазмид. РНК из этих спейсеров направляет другие Cas-белки атаковать любую вторгающуюся ДНК или РНК, соответствующую последовательности.
Как бактерии и археи обзавелись такими сложными иммунными системами? На этот вопрос еще предстоит ответить, но ведущая теория состоит в том, что эти системы происходят из транспозонов — «прыгающих генов», которые могут перескакивать из одной позиции в другую в геноме. Эволюционный биолог Юджин Кунин из американского Национального института здоровья в Бетесде, штат Мэриленд, и его коллеги нашли класс таких мобильных генетических элементов, которые кодируют белок Cas1, который участвует в создании спейсеров в геноме. Эти «каспозоны», предполагает он, могут быть началом иммунитета CRISPR-Cas. Теперь ученые работают над тем, чтобы понять, как эти участки ДНК прыгают с одного места в другое — и затем отследить, как этот механизм мог привести к усложнению CRISPR-Cas.
Как он работает?
Многие молекулярные детали того, как белки Cas добавляют распорки, стали хорошо изучены в последние годы. Но вирусная ДНК химически почти идентична ДНК хозяина. Как в клетке с ДНК белки узнают, какую ДНК добавлять к памяти CRISPR-Cas?
Ставки высоки: если бактерия добавляет часть своей собственной ДНК, существует риск самоубийства, аутоиммунной атаки, говорит Виджиниюс Сикснис, биохимик Университета Вильнюса в Литве. «Эти ферменты являются ободоюстрым мечом».

Вполне возможно, что популяции бактерий и архей могут поглощать некоторые ошибки, говорит Родольф Баррангоу, микробиолог Университета штата Северная Каролина в Роли. Несколько клеточных суицидов могут не иметь значения, если другие клетки будут жить после вирусной атаки.
На самом деле, когда вирусы проникают в бактериальную экосистему, зачастую лишь одна бактерия из 10 миллионов получает спейсер, позволяющий ей защищаться. Эти шансы усложняют изучение появления этих спейсеров, а также понимание, почему одни клетки преуспевают, а другие терпят неудачу. «Трудно поймать бактерию, когда это действительно происходит», говорит Лучано Маррафини, микробиолог из Университета Рокфеллера в Нью-Йорке.
Может быть полезной сортировка в процессе определения подходящих спейсеров — и повышения скорости их включения. Некоторые исследования показали, что клетки, содержащие механизмы CRISPR-Cas, могли бы служить в качестве записывающего устройства разного рода, каталогизируя последовательности ДНК и РНК, с которыми встречаются. Это может позволить ученым отслеживать экспрессию гена клетки или воздействие на окружающую среду с течением времени.
Исследователи также хотели бы узнать, как старые воспоминания извлекаются из коллекции. Большинство микробов с системами CRISPR-Cas содержат лишь несколько десятков спейсеров; некоторые — только по одному. Архея Sulfolobus tokodaii, напротив, посвящает 1% своего генома 5 системам CRISPR-Cas, включающим 458 спейсеров.
Может быть не так много стимулов придерживаться старых спейсеров: если вирус мутирует, чтобы обойти CRISPR-Cas, спейсер становится устаревшим. И может быть бременем для микробов, которые будут пытаться сохранить лишнюю ДНК. «Бактерия не может надувать свой геном вечно», говорит Ротем Сорек, генетик из Института Вейцмана в Реховоте, Израиль.
Что еще он может делать?
Происхождение некоторых спейсеров представляет другую загадку. Меньше 3% наблюдаемых на текущий момент спейсеров соответствуют каким-нибудь известным последовательностям в базах данных ДНК.
Это может отражать, как мало мы знаем о вирусах. Большинство попыток секвенирования были посвящены тем, которые инфицируют людей, домашний скот или урожаи. «Мы очень мало знаем об этих врагах бактерий, и особенно о врагах странных архей», говорит Майкл Тернс, биолог РНК в Университете Джорджии в Афинах.
Также возможно, что некоторые спейсеры являются призраками вирусов, которых уже нет или которые мутировали до неузнаваемости. Но есть и третья возможность, которая нравится ученым. Исследователи обнаружили примеры того, как системы CRISPR-Cas делали много больше, чем просто боролись с генетическими злодеями. У некоторых бактерий компоненты CRISPR-Cas управляли починкой ДНК, экспрессией генов и образованием биопленок. Они также могли определить способность бактерии инфицировать других: Leginella pneumophila, вызывающая болезнь легионеров, должна была иметь Cas-белок Cas2, чтобы инфицировать амебу, которая является ее природным носителем.
«Большой вопрос в том, как сильно биология уходит за рамки защиты», говорит Эрик Сонтеймер, молекулярный биолог из Университета Массачусетса. «В ближайшие годы появится много новой информации».
Сонтеймер добавляет, что все это образует любопытную параллель с открытием РНК-интерференции — системы, которая глушит экспрессию генов у растений, животных и других не-прокариот. РНК-интерференция также в первую очередь рассматривалась как механизм защиты, а лишь затем исследователи заметили ее роль в регуляции экспрессии генов носителя.
Это также могло бы объяснить, почему некоторые спейсеры не совпадают с известными вирусами или плазмидами, говорит Стэн Броунс, микробиолог Технического университета Делфта в Нидерландах.
«Эти системы не настроены, чтобы быть совершенными: они хватают вирусную ДНК, а также собственную», говорит он. «Как только они начинают притягивать новые кусочки ДНК, они могут получать новые функции — если не умирают».
Почему не все микробы его используют?
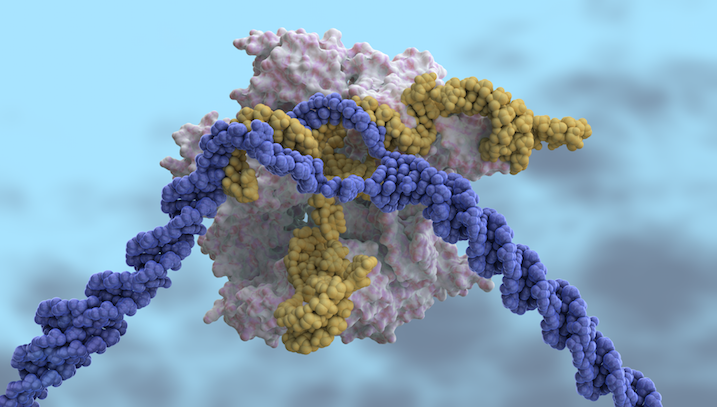
Независимо от других функций, которые имеет CRISPR-Cas, очевидно, что некоторые микробы используют его больше, чем другие. Более 90% архей имеют иммунитет на основе CRISPR, в то время как лишь одна треть секвенсированных бактерий возится с ним, говорит Кунин. А среди не-прокариот, даже одноклеточных, ни разу не видели озадаченности CRISPR-Cas.
Одна архея, Nanoarchaeum equitans, живет как паразит на другой архее в почти кипящей воде и разделяет с ним многие его гены, связанные с производством энергии и общим ведением домашнего клеточного хозяйства. Тем не менее, в своей крошечной 490 000-буквенной инструкции ДНК, N. equitans придерживает в системе CRISPR-Cas около 30 спейсеров. Большой кусок своего генома она посвящает CRISPR. Выходит, CRISPR может быть очень важным, но ученые пока не знают почему.
Такие различия позволяют предположить, что существуют ключевые экологические факторы, которые способствуют развитию системы CRISPR-Cas и предпочитают защиту от вирусов — или другие выгоды — даже несмотря на угрозу клеточного суицида, говорит Эдж Вестра, микробиолог Университета Эксетера в Великобритании. Экстремальные условия, кажется, играют на пользу системам CRISPR-Cas, но Вестра отмечает, что частота таких систем также варьируется среди бактерий в более гостеприимных местах обитания. Птичий возбудитель Mycoplasma gallisepticum, например, отказался от своего инвентаря CRISPR-Cas, когда перешел от цыплят к диким вьюркам. Почему эта система была полезна для птиц, но не для зябликов, можно только догадываться.
Математические модели и первые лабораторные эксперименты показывают, что CRISPR-Cas может быть преимуществом, только если ему приходится бороться лишь с несколькими типами вирусов. Спейсеры CRISPR-Cas могут записывать ограниченное число вирусных последовательностей, прежде чем добавленная ДНК становится геномическим бременем. Если разнообразие вирусов в окружающей среде сильно превосходит число возможных спейсеров, системы CRISPR-Cas не найдут должного применения, говорит Кунин. Другая возможность в том, что археи в экстремальной среде не могут в должной степени полагаться на другие средства защиты. Один из распространенных способов борьбы с вторженцами у бактерий — это мутация белков, обнаруживаемых в среде, в собственную оболочку. У архей может быть не так много вариантов мутации внешней оболочки, поскольку она служит немного для других задач, в частности, для защиты от агрессивной среды, поэтому системы CRISPR могут быть более подходящими.
Сколько существует видов CRISPR-Cas?
Люди выбрали систему CRISPR-Cas9 за ее простоту и универсальность в редактировании генома, но микробы не выбирают любимчиков. Вместо этого они склонны смешивать и сочетать различные системы, быстро подбирая новые у других бактерий и отказываясь от старых.
Исследователи официально признали 6 различных типов систем CRISPR с 19 подтипами. «И в действительности мы знаем, как работает лишь часть их», говорят ученые.
Раскрытие этих механизмов могло бы дать ключ к поиску новых биотехнологических применений систем CRISPRS-Cas. Полюбившаяся система CRISPR-Cas9, например, представляет собой систему типа II. Но есть еще типы III, IV, V, VI и другие.
Системы типа III чаще всего встречаются в природе — и понятны меньше других. Понимание новых систем позволит расширить набор инструментов для редактирования генома.
Для Мохики исследование разнообразия и поиск ответов на основные вопросы о системах CRISPR представляют собой больше, чем привлекательность революции, которую они могут начать. Он погрузился в биологию CRISPR-Cas двадцать пять лет назад, и хотя для тех, кто желает возиться с изменением генома, сейчас открыты все финансовые возможности, их гораздо меньше для тех, кто занимается сугубо теорией.
«Я знаю, что это отличный инструмент. Он невероятен. Его можно использовать для лечения заболеваний», говорит Мохика. «Но это не мое дело. Я хочу знать, как эта система работает от самого начала и до конца».
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России