Как победить вирус? Часть 1
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Уже давно бьют тревогу по поводу возникновения резистентных к антибиотикам штаммов бактерий, хотя некоторые серьёзные заболевания являются вирусными и также требуют скорейших мер по взятию их под контроль.
К таким заболеваниям относятся, конечно, СПИД, вызываемый вирусами иммунодефицита человека, гепатит С, который, если его не лечить, во многих случаях может приводить к злокачественным новообразованиям печени и циррозу, герпес, грипп типа А, бешенство, геморрагическая лихорадка Эбола и некоторые другие.
Принципиальное отличие жизненнного цикла вируса от жизненного цикла бактерии заключается в том, что вирус — это облигатный внутриклеточный паразит. Фактически вирус вне клетки мёртв, так как не может ни размножаться, ни самостоятельно перемещаться, ни демонстировать каких-либо иных признаков жизни. Вся его жизнь, которая заключается исключительно в воспроизведении себе подобных, протекает только при попадании в вожделенное начало всех начал — клетку.
Безусловно, именно этот факт и определяет мишени фармакологического воздействия при вирусных заболеваниях.
В фармакологии инфекционных и паразитарных заболеваний (отчасти это справедливо и для случая злокачественных новообразований), существует 2 принципиально различных типа лекарственного воздействия. Одно из них направлено на модификацию макроорганизма-хозяина, то есть человека, с целью выработки устойчивости к инфекционному агенту или усиления защитных свойств организма. Классический пример — вакцинация. Второй тип лекарственного воздействия направлен на модификацию (ослабление, уничтожение) паразита, то есть патогенного агента. Классический пример этого типа – применение антибиотиков.
Меня, как химика, прежде всего интересует использование при вирусных заболеваниях так называемых малых молекул, которым и будет посвящена данная статья.
Так что же дают медицинскому химику, который занимается конструированием лекарственных средств, знания в области вирусологии? Прежде всего, они позволяют определить точки приложения лекарственной молекулы. Вот и пройдёмся по ним.
Представьте, что вы — попавший в организм вирус. Перед вами — пустыня, почти голая, почти безжизненная клетка с мембраной. Что будете делать? Понятно, что в клетку как-то надо проникнуть. Но, сори, просто так вам туда войти никто не даст. Для диффузии, хоть простой, хоть облегчённой, вы слишком велики. Никаких специальных каналов и белковых-переносчиков вам матушка эволюция не оставила. А вы что хотели: чтоб как в сказке, да ещё с проницаемыми мембранами? Щаз.
Но, как говорится, и вы не лышком шиты. А вирусной оболочкой, или капсидом.

Хочу заметить, что капсид состоит из белков, но некоторые вирусы имеют и суперкапсид. Суперкапсид — это липидная оболочка, захваченная вирусом при выходе из клетки хозяина. Как она образуется у ВИЧ, можно посмотреть на рисунке ниже
В дальнейшем я буду писать «капсид», подразумевая в тех случаях, где речь идёт об оболочечных вирусах, что может быть и суперкапсид.
Капсид имеет на своей поверхности «отростки», чаще всего из гликопротеинов, которые связываются с каким-либо из многочисленых типов рецепторов, торчащих из клетки. Рецепторы эти, естественно, нужны вовсе не для проникновения вируса в клетку, а для получения сигналов из вне для нормальной жизнедеятельности.
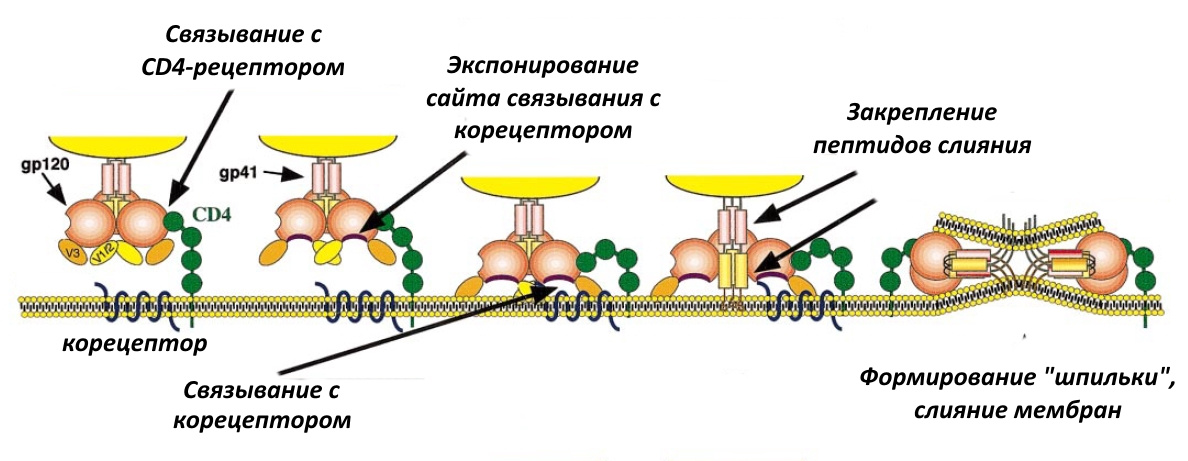
К примеру, если вы — ВИЧ, то облюбуете себе СD4-рецептор, который встречается на поверхности клеток иммунной системы (лимфоцитов, моноцитов, макрофагов, клеток Лангерганса, дендритных клеток), а также клеток микроглии — по сути, компонента иммуной системы головного и спинного мозга.
Если вы домосед, не хотите переезжать с места на место в шастающих туда-сюда клетках иммунной системы, то всегда можно одеться в личину вируса гепатита В или С. В первом случае к вашим услугам предоставляется натрий-зависимый транспортёр желчных кислот, открывающий уютные комфортабельные аппартаменты гепацитов печени. В случае гепатита С, что, кстати, встречается в вирусном мире редко, для попадания в гостеприимный гепацит вирус использует несколько рецепторов.
Любителям альпийского высокогорья прохлады и свежего воздуха могу порекомендовать стать вирусом гриппа и облюбовать эпителий верхних дыхательных путей. В мир упоительного блаженства вам проложат путь остатки сиаловых кислот, которые прочно свяжутся с гемагглютинином на поверхности вашего капсида.
Короче, принцип понятен — выбираете курорт по своим предпочтениям, а дальше — дело техники.
Очевидно, что связывание частей капсида с рецепторами на поверхности клетки является слабым звеном вирусной агрессии и может быть использовано для фармакологической атаки. Следуя логике, можно предложить два подхода, каждый из которых имеет свои недостатки. Во-первых, можно заблокировать гликопротеин на поверхности вируса, а во-вторых — рецептор на поверхности клетки. Если пойти по второму пути, то мы рискуем нарушить нормальную жизнедеятельность: клетка перестанет получать сигналы из вне и загнётся. А если это клетка иммунной системы, то можно потерять и весь макроорганизм. Кажется, что проще и безопаснее заблокировать вирусный гликопротеин. И это действительно так. Однако вирусы (особенно РНК-содержащие) очень сильно изменчивы, то есть быстро мутируют, поэтому созданный препарат может вскоре перестать работать. Отсюда, кстати, следует вывод о том, что мишенью для препарата должны стать наименее вариабельные (изменчивые) части капсида.
Теперь немножко примеров из клинической практики.
Существует 2 препарата, которые действуют на ВИЧ и препятствуют его попаданию в клетку. Первый, как это ни странно, использует химиотерапевтическую стратегию № 1, то есть модифицирует макроорганизм. Препарат называется маравирок и был разработан британским филиалом Pfizer в первой половине 2000-х. Механизм его действия такой. Чтобы проникнуть в клетку, ВИЧ использует не только CD4-рецептор, но и корецептор иммунных клеток, CCR5 (см. рис. выше). Маравирок изменяет пространственную структуру этого рецептора таким образом, что ВИЧ уже не в состоянии за него ухватиться и проникнуть в клетку.

Обратите внимание, что молекула маравирока связывается с CCR5 как многочисленными водородными связями, так и электростатически.
Второй ингибитор слияния, как называют лекарства этого класса, энфувертид, не является классической малой молекулой, а представляет собой пептид — цепочку из из 36 аминокислот, первая из которых модифицирована остатком уксусной кислоты.
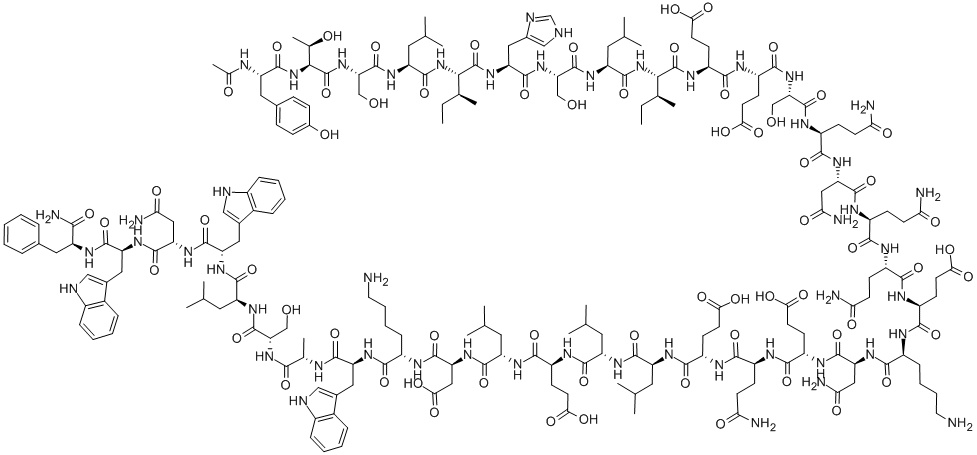
Она присоединяется к одному из гликопротеинов ВИЧ и блокирует его работу по внедрению частиц вируса в клетку на последнем этапе проникновения, когда происходит объединение суперкапсида (ВИЧ является оболочечным вирусом) и мембраны клетки. Весьма наглядно это показано в следующем ролике:
В разработке находятся ещё несколько лекарств из класса ингибиторов слияния, предназначенных для терапии ВИЧ и гепатитов. Посмотрим, насколько это направление окажется перспективным.
Продолжим.
Итак, на ресепшене вам дали ключи, и вы широко распахнули ворота клетки, призывно манящей своим содержимым. Что дальше?
Часть вирусов, и среди них ВИЧ, попадает после проникновения в клетку напрямую в цитоплазму, покинув остатки суперкапсида на поверхности цитоплазматической мембраны. Другие вирусы проделывают более сложный путь.
Так, связавшись гликопротеинами с клеточными рецепторами, вирус может попасть в клетку путём эндоцитоза, то есть вместе с выпячиваниями клеточной мембраны, формирующими пузырьки-эндосомы.
Со временем содержимое эндосомы закисляется, то есть его рН понижается. И тут вам за несколько сотен тысяч лет эволюции надо было успеть подсуетиться, а не щёлкать капсидом. К примеру, вирус гриппа создал специальный М2-белок.
Он представляет собой канал, по которому внутрь вирусной частицы устремляются протоны. В результате происходят следующие события:
— электростатическое взаимодействие между капсидом и нуклеопротеином (комплексом нуклеиновых кислот и белков) ослабляется, и они отсоединяются друг от друга;
— пептиды слияния встраиваются в стенку эндосомы, содержимое суперкапсида и цитоплазмы объединяется.
Таким вот образом в цитоплазму клетки попадает основная «рабочая» часть вируса, которая впоследствии захватывает весь свой гостиничный номер, — нуклеиновая кислота.
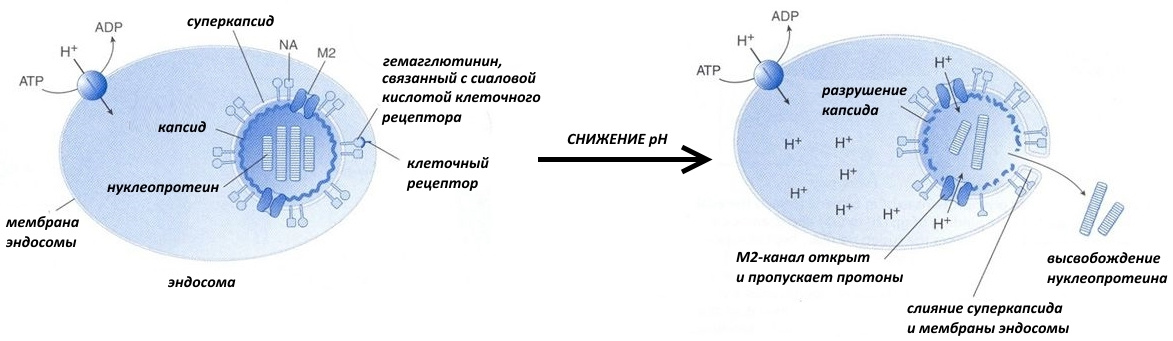
Как работает M2-белковый канал.
Несмотря на многочисленные исследования, как работает M2-белок, понятно не до конца. Тем не менее, консенсус относительно неких принципиальных вещей в научном мире всё
же есть. M2-белок представляет собой тетрамер, то есть состоит из 4 субъединиц и имеет 3 функциональных части. Трансмембранный сегмент образует проницаемый для протонов канал, а С- и N-концевые сегменты удерживают тетрамеры, чтобы те не «разъехались» при открывании канала.
Внутрь канала обращены остатки аминокислот гистидина (His37 или H37) и триптофана (Trp41 или W41), которые, как полагают, играют ключевую роль в обеспечении его протонной проводимости.
При физиологических значениях рН только 2 из 4 гистидиновых остатков протонированы, их имидазольные части находятся почти перпендикулярно α-спиралям тетрамеров.
Остатки триптофана также перпендикулярны α-спиралам. В таком положении им помогают удерживаться водородные связи пиррольных колец с остатками аспарагиновой кислоты.
При закислении содержимого эндосомы происходит дополнительное протонирование 1 или 2 остатков гистидина, силы электростатического отталкивания начинают превосходить
силы водородных связей, имидазольные фрагменты выходят из плоскости, перпендикулярной каналу, и открывают его для протонов.

Далее происходит поворот остатков триптофана в сторону протонированного имидазола по причине образования π-комплекса с его бензольной частью. Таким образом, триптофановые остатки также выходят из плоскости, их водородная связсь с остатками аспарагиновой кислоты разрывается, в результате чего протон проходит по образовавшемуся каналу далее вглубь вириона. Вуаля!

Итак, очевидно, что мы снова имеем болевую точку — раздевание капсида вируса гриппа при закислении эндосом. И этим грех не воспользоваться.
Заблокировать М2-белковый протонный канал можно с помощью знакомого вам римантадина, который получил широкое распространение в странах бывшего СССР, и амантадина, более известного в США.
Эти соединения одновременно содержат фрагменты каркасного углеводорода адамантана, которые могут выступать заглушкой канала, образованного M2-белком, а также аминогруппы, которые позволяют удерживаться водородными и/или электростатическими связями (после протонирования) с соответствующими аминокислотными остатками.
Отличительной чертой многих РНК-вирусов, к которым принадлежит и вирус гриппа А, является высокая частота мутаций. Если вы помните, так называемый свиной грипп H1N1, который пришёл из Мексики в 2009 и уже давно стал частью циркулирующих сезонных вирусов, устойчив к производным адамантана из-за мутаций в трансмембранном сегменте белка M2. Так что более назначение этих лекарств при гриппе не рекомендуется.
Ой, а что случилось?
С помощью ядерного магнитного резонанса установлено, что производные адамантана внутри канала застревают на уровне остатков аминокислоты серина (S31 на рисунке выше). Однако очень часто в результате мутации остаток серина заменяется на аспарагин. При этом, как полагают, диаметр канала увеличивается, и молекула лекарственного средства уже не может прочно в нём удерживаться, таким образом канал остаётся заблокированным меньшее время, что позволяет вирусу делать своё чёрное дело.
В настоящее время ведутся разработки соединений, который бы могли затыкать или иным образом нарушать работу М2-канала у мутировавших штаммов вирусов, однако, несмотря на обилие публикаций, о клинических испытаниях подобного рода соединений мне не известно.
Продолжение следует.
Вопросы для самоконтроля. Ну первое сентября же!
- Почему вирусы растений не имеют суперкапсида?
- Какие преимущества даёт вирусу возможность связывания с несколькими рецепторами?
- Известно, что ВИЧ-1 может связываться с 2 корецепторами: CCR5 и СXCR4. Как этот факт может сказаться на эффективности препарата маравирок?
- Каким образом может сказаться на эффективности препарата маравирок замена в его молекуле 2 атомов фтора на 2 атома хлора? Поясните свой ответ.
- Энфувертид вводится в организм человека только инъекционно. Как, по-вашему, с чем это связано?
- В литературе встречается следующее неправильное объяснение механизма действия римантадина и амантадина: указывается, что эти препараты блокируют
закисление эндосом, поскольку являются веществами основной природы (аминами). Какой описанный в статье экспериментальный факт опровергает такое объяснение?
7. Какую модификацию молекул ремантадина и амантадина вы бы предложили провести, чтобы их производные смогли действовать на S31N мутанты?
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России