Как устроена депрессия?
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Классификация депрессивных расстройств; роль моноаминов (дофамина, норадреналина и серотонина); механизмы действия антидепрессантов; депрессия, стресс и нейропластичность.
Депрессия (от лат. Deprimo — подавить) — психическое заболевание, характеризующееся «депрессивной триадой», включающей в себя следующие нарушения:
- В эмоциональной сфере. Подавленное настроение и ангедония — невозможность извлечь удовольствие из естественных вещей: еды, алкоголя, общения, секса и т.д.
- В когнитивной сфере. Негативный образ себя, негативный опыт мира, негативное видение будущего — это, так называемая, «когнитивная триада». Триада внутри триады + человек неспособен к адекватной оценке ситуации, не может применить предшествующий позитивный опыт решения проблемы.
- В двигательной сфере. Как правило, двигательная заторможенность, но может наблюдаться и обратная реакция — ажитированное возбуждение: больной в спокойной обстановке может постоянно вскакивать, размахивать руками, постоянно менять позу, или, например, встать и уйти посредине разговора.
 Психиатрия: национальное руководство. М.: ГЭОТАР-Медиа, 2009. 1000 с.
Психиатрия: национальное руководство. М.: ГЭОТАР-Медиа, 2009. 1000 с.
Есть еще дополнительные симптомы: потеря или усиление аппетита (потеря или набор веса), нарушения сна (сонливость или бессонница), чувство усталости, повышенная утомляемость и т.д.
По данным ВОЗ (Информационный бюллетень №369) от депрессии страдает более 300 миллионов человек, и этот показатель имеет тенденцию к росту. Депрессия отличается от обычных изменений настроения и кратковременных эмоциональных реакций на проблемы в повседневной жизни. Она может привести к серьезным нарушениям здоровья, социальной дезадаптации, снижению работоспособности и обучения. В худших случаях может приводить к самоубийству.
Ежегодно около 800 000 человек погибают в результате самоубийства — второй по значимости причины смерти среди людей в возрасте 15–29 лет.
 Рис. 1 Depression: The Treatment and Management of Depression in Adults (Updated Edition). Leicester (UK): British Psychological Society, 2010.
Рис. 1 Depression: The Treatment and Management of Depression in Adults (Updated Edition). Leicester (UK): British Psychological Society, 2010.
Давайте взглянем на упрощенную классификацию депрессивных расстройств (рис.1), которая не является абсолютной, но включает основные примеры. Депрессии можно классифицировать по причине, их вызвавшей (этиологии), и преобладанию тех или иных симптомов, а также их различных сочетаний.
В первом случае можно выделить три категории:
- **Психогенные ** (реактивные) депрессии вызваны психотравмирующим фактором. Этот фактор фигурирует в речи больного. Как правило, такие депрессии могут разрешаться самостоятельно по прошествии времени, прекращении действия фактора — «время лечит».
- **Эндогенные ** — депрессии, вызванные, как полагают, внутренними факторами, которые не удается установить.
- Соматогенные **— вызванные патогенезом (механизмом развития болезни) различных заболеваний. Важно не путать их с психогенными. Например, если у человека депрессия от **осознания наличия какой-то болезни — это психогенная (реактивная) депрессия. К соматогенным относятся те депрессии, которые вызваны механизмом другого заболевания. Например, при болезни Паркинсона погибают нервные клетки, вырабатывающие дофамин, который, в свою очередь, играет важную роль в эмоциональной реакции. Дефицит дофамина в областях мозга, ответственных за эмоциональную реакцию, приводит к депрессии. Вторым примером может служить псориаз, который может приводить к уменьшению продукции серотонина (важного регулятора настроения) в ЦНС, и таким образом повышать риск развития депрессивных расстройств.
По преобладающему симптому депрессии могут быть: тревожные, тоскливые, адинамические, анестетические (переживание отсутствия эмоций — «эмоциональная анестезия») — это примеры «простых депрессий».
«Сложные депрессии» сочетают в себе симптомы депрессии и других психопатологий: депрессии с бредом, галлюцинациями, кататонические, маскированные — симптомы маскируются под заболевания внутренних органов или по-другому «соматизируются» — головные боли, боли в животе, сердце и т.д.
Сложность терапии депрессивных расстройств заключается в отсутствии полного выздоровления в случае тяжелых или осложненных форм депрессивных расстройств. Но также возможно саморазрешение данного заболевания, если течение не тяжелое, нет осложнений в виде симптомов других психопатологий и т.д.
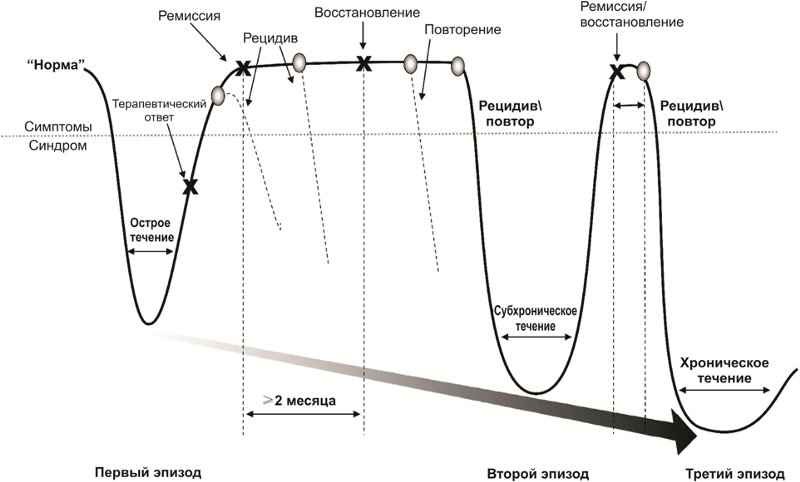 Характер течения депрессивных расстройств
Характер течения депрессивных расстройств
После успешного курса лекарственной и психотерапии наступает период ремиссии, который сопровождается либо ослаблением (частичная ремиссия), либо полным исчезновением симптомов (полная ремиссия) заболевания. В период активного лечения и частичной или полной ремиссии сохраняется риск возвращения симптоматики заболевания — рецидива.
Кроме того, существуют риски повторных эпизодов депрессии после полного восстановления от первого эпизода. Повторные эпизоды могут характеризоваться набором других симптомов и более тяжелым течением. Заболевание может приобретать хроническое течение. Зачастую, первый эпизод депрессивного расстройства бывает психогенным (реактивным), а повторные (в случае, если проблема неразрешима, психотравмирующий фактор был слишком сильным или затяжным) — эндогенными.
Серотонин, норадреналин и дофамин
На рисунке 2 тезисно представлены основные параметры моноаминовой теории депрессии. Формулы моноаминов приведены для объяснения названия этой группы веществ — они содержат только одну аминогруппу (-NH2).
Роль моноаминов в развитии депрессивной симптоматики
 Рис. 2 Моноаминовая теория депрессии
Рис. 2 Моноаминовая теория депрессии
**Еще одна NH-группа у серотонина не является аминогруппой, это часть гетероцикла индола.*
Считается, что роль моноаминов в формировании отдельных симптомов депрессии неоднородна. Так, за чувство вины и никчемности, суицидальные идеи, а также нарушение аппетита может отвечать дефицит серотонина.
Дофамин и норадреналин отвечают за апатию, исполнительную дисфункцию и усталость.
Дефицит всех моноаминов в комплексе говорит о подавленном настроении, психомоторной дисфункции и нарушении сна.
 Рис.3. Saltiel P.F., Silvershein D.I. Major depressive disorder: mechanism-based prescribing for personalized medicine // Neuropsychiatr Dis Treat. 2015. 11. P. 875–88.
Рис.3. Saltiel P.F., Silvershein D.I. Major depressive disorder: mechanism-based prescribing for personalized medicine // Neuropsychiatr Dis Treat. 2015. 11. P. 875–88.
На рисунке 3 показаны отделы головного мозга, где нарушения функции представленных моноаминов приводит к развитию депрессивной симптоматики.
Как мы уже говорили, все современные клинически эффективные антидепрессанты созданы в рамках моноаминовой теории депрессии.
Антидепрессанты
Условно принцип действия антидепрессантов можно разделить на две группы:
- Средства, которые повышают концентрацию моноаминов (главным образом серотонина и норадреналина) в головном мозге;
- Средства, которые берут на себя функцию моноаминов (главным образом, серотонина), стимулируя специфические рецепторы.
 Рис.4
Рис.4
Рассмотрим подробнее основные группы молекулярных механизмов антидепрессантов. На рисунке 5 показан синаптический контакт между двумя нервными клетками: сверху — нервное окончание одного нейрона (синапса), снизу — другая нервная клетка, которая принимает сигнал.
Основные молекулярные механизмы антидепрессантов в контексте моноаминовой гипотезы депрессии
 Рис. 5. Drug Therapy of Depression and Anxiety Disorders. Goodman and Gilman’s The Pharmacological Basis of Therapeutics. Twelfth Edition. 2011. Stahl S.M. Basic psychopharmacology of antidepressants. Part 1: Antidepressants have seven distinct mechanisms of action // The Journal of Clinical Psychiatry. 1998. 59. Suppl 4. P. 5–14.
Рис. 5. Drug Therapy of Depression and Anxiety Disorders. Goodman and Gilman’s The Pharmacological Basis of Therapeutics. Twelfth Edition. 2011. Stahl S.M. Basic psychopharmacology of antidepressants. Part 1: Antidepressants have seven distinct mechanisms of action // The Journal of Clinical Psychiatry. 1998. 59. Suppl 4. P. 5–14.
В нервных клетках происходит синтез нейромедиаторов (серотонина и норадреналина), с помощью которых клетки передают сигнал друг другу. Исходным веществом для синтеза являются незаменимые аминокислоты — L-триптофан и L-фенилаланин. После синтеза медиаторы упаковываются в особые гранулы — везикулы, в составе которых они продвигаются к нервным окончаниям (синапсам) и депонируются там.
После получения клеткой определенного стимула медаторы выделяются из нервного окончания (синапса) в синаптическую щель — зазор между двумя нервными клетками. На поверхности «принимающей» сигнал клетки есть особые белковые образования — рецепторы (в данном случае серотониновые и адренорецепторы), которые связываются с медиатором. После связывания медиатор активирует (стимулирует) соответствующий рецептор, что приводит к изменению обменных процессов внутри клетки и соответственно изменяет ее функцию (усиливает или подавляет).
После успешного выполнения своей функции 80% медиатора захватывается обратно в нервную клетку, где часть медиатора разрушается ферментом моноаминоксидазой типа А (МАО-А), а часть снова упаковывается в везикулы для повторного использования. Обратный захват медиатора позволяет значительно сократить энергетические затраты на синтез медиатора из аминокислот.
 Рис. 6 Минусы перевешивают и обосновывают поиск новых гипотез и мишеней.
Рис. 6 Минусы перевешивают и обосновывают поиск новых гипотез и мишеней.
Коротко о том, как действуют антидепрессанты

- Нарушают обратный захват медиатора в нервное окончание, тем самым повышая его концентрацию в синаптической щели и усиливая его действие на рецепторы. Возможно как раздельное нарушение обратного захвата серотонина (флуоксетин, флувоксамин, пароксетин) и норадреналина (ребоксетин, атомоксетин), так и одновременное нарушение захвата обоих медиаторов (амитриптилин).
- Усиливают выброс медиаторов из нервных окончаний (миртазапин и запрещенный в настоящее время тианептин).
- Подавляют активность фермента МАО-А и тем самым сохраняют медиатор от разрушения (моклобемид).
- Стимулируют серотониновые рецепторы 1 подтипа (вилазодон), активация которых связана с облегчением депрессивной симптоматики («хорошие» рецепторы).
- Блокируют серотониновые рецепторы 2 типа («плохие» рецепторы), которые отвечают за развитие тревожной и депрессивной симптоматики (тразодон).
Депрессия и стресс
В настоящее время стрессу отводится роль одного из пусковых (триггерных) механизмов аффективных расстройств (расстройства эмоциональной сферы, аффекта), в том числе и депрессивных. Как полагают, опасно не однократное и сильное стрессовое событие, а менее интенсивное и постоянное воздействие стресса, особенно повседневные непредсказуемые стрессовые события. Адаптироваться к такому стрессовому воздействию невозможно, и оно приводит к хронической активации механизмов защиты и адаптации с последующим их истощением.
Одним из важнейших компонентов физиологической реакции организма на стресс является гипоталамо-гипофизарно-надпочечниковая ось (рис. 7).
 Рис. 7. Varghese F. P. & Brown E. S. The Hypothalamic-Pituitary-Adrenal Axis in Major Depressive Disorder: A Brief Primer for Primary Care Physicians // Primary Care Companion to The Journal of Clinical Psychiatry. 2001. 3(4). P. 151–155.
Рис. 7. Varghese F. P. & Brown E. S. The Hypothalamic-Pituitary-Adrenal Axis in Major Depressive Disorder: A Brief Primer for Primary Care Physicians // Primary Care Companion to The Journal of Clinical Psychiatry. 2001. 3(4). P. 151–155.
Последовательная активация стрессом центральных структур (миндалины — гипоталамуса — гипофиза) приводит к выработке гормонов коры надпочечников — глюкокортикоидов (кортизола) — гормоны стресса. Последние способны действовать на структуры мозга (ответственны за эмоционально-стрессовую реакцию (префронтальная кора и гиппокамп)) и нарушать процессы нейропластичности.
Нарушения нейропластичности*
Нарушения нейропластичности приводят к нарушению нормальной связи между структурами головного мозга (ответственными за эмоциональную реакцию).
Нейропластичность — это способность мозга адаптироваться к изменениям путем реорганизации, при нормальном развитии и в условиях патологии.
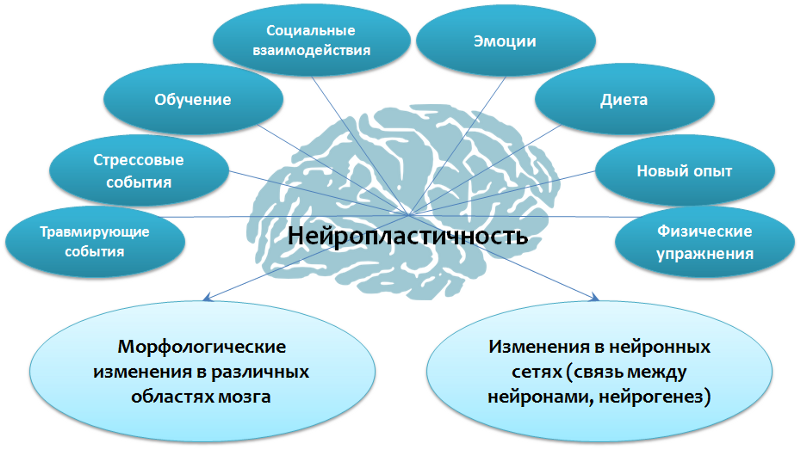 Рис. 8 Fuchs E., Flügge G. Adult Neuroplasticity: More Than 40 Years of Research // Neural Plasticity. 2014. Article ID 541870. Doi:10.1155/2014/541870; Joyce Sh. Neuroplasticity and Clinical Practice: Building Brain Power for Health // Frontiers in Psychology. 7 (2016): 1118. PMC. Web. 7 May 2017. Zilles K. Neuronal plasticity as an adaptive property of the central nervous system // Annals of Anatomy. 1992. Vol. 174. No. 5. P. 383–391.
Рис. 8 Fuchs E., Flügge G. Adult Neuroplasticity: More Than 40 Years of Research // Neural Plasticity. 2014. Article ID 541870. Doi:10.1155/2014/541870; Joyce Sh. Neuroplasticity and Clinical Practice: Building Brain Power for Health // Frontiers in Psychology. 7 (2016): 1118. PMC. Web. 7 May 2017. Zilles K. Neuronal plasticity as an adaptive property of the central nervous system // Annals of Anatomy. 1992. Vol. 174. No. 5. P. 383–391.
Наиболее важными в контексте депрессивных расстройств представляются префронтальная кора, миндалина и гиппокамп.
Взаимодействие структур головного мозга в норме
 Рис. 9. Gorman J.M., Docherty J.P. A Hypothesized Role for Dendritic Remodeling in the Etiology of Mood and Anxiety Disorders // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010. 22:3. P. 256–264
Рис. 9. Gorman J.M., Docherty J.P. A Hypothesized Role for Dendritic Remodeling in the Etiology of Mood and Anxiety Disorders // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010. 22:3. P. 256–264
В норме, когда существует полноценная связь между нейронами этих структур, префронтальная кора обрабатывает информацию, полученную от гиппокампа (память, эмоциональная окраска воспоминаний и событий). Миндалина — это структура, ответственная за чувство страха. В норме чрезмерную активность этой структуры подавляет префронтальная кора.
 Рис. 10
Рис. 10
Известно, что на фоне депрессивных расстройств нарушаются процессы нейропластичности, в частности снижается число контактов между нервными клетками, изменяется скорость передачи импульса, уменьшается количество нейронов. Кроме того, на фоне депрессии отмечают уменьшение объема гиппокампа и префронтальной коры. Подобные изменения способствуют нарушению нормальной функциональной связи между представленными структурами.
Депрессивная симптоматика, по-видимому, может быть опосредована этими изменениями: неконтролируемая тревога, которая часто имеет место у больных с депрессией может быть следствием отсутствия торможения миндалины префронтальной корой.
Взаимодействие структур головного мозга при депрессии (теория)
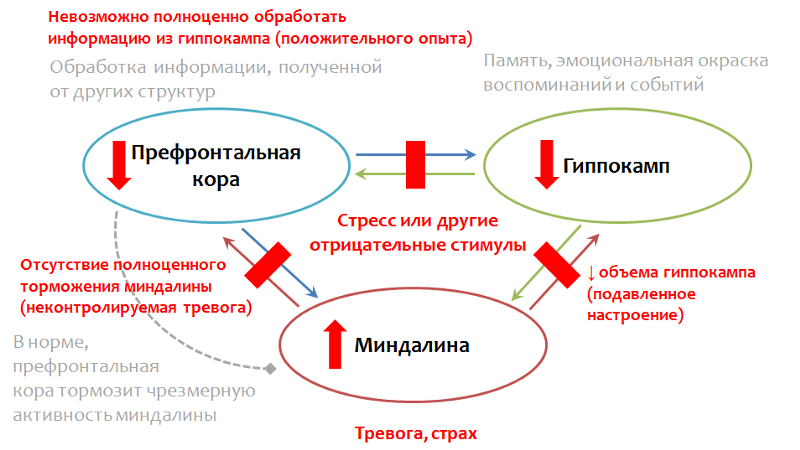 Рис.11. Gorman J.M., Docherty J.P. A Hypothesized Role for Dendritic Remodeling in the Etiology of Mood and Anxiety Disorders. The Journal of Neuropsychiatry and Clinical Neurosciences. 2010. 22(3). P. 256–64. Кудряшов Н.В. Экспериментальное изучение психотропной активности производных пиразоло[c]пиридина ГИЖ-72 и пирролодиазепина ГМАЛ-24 в условиях непредсказуемого хронического умеренного стресса / Диссертация кандидата Биологических наук. 14.03.06. М., 2016. 198 с.
Рис.11. Gorman J.M., Docherty J.P. A Hypothesized Role for Dendritic Remodeling in the Etiology of Mood and Anxiety Disorders. The Journal of Neuropsychiatry and Clinical Neurosciences. 2010. 22(3). P. 256–64. Кудряшов Н.В. Экспериментальное изучение психотропной активности производных пиразоло[c]пиридина ГИЖ-72 и пирролодиазепина ГМАЛ-24 в условиях непредсказуемого хронического умеренного стресса / Диссертация кандидата Биологических наук. 14.03.06. М., 2016. 198 с.
Невозможность адекватно оценить ситуацию и использовать предшествующий положительный опыт — результат нарушения связи между префронтальной корой и гиппокампом. Уменьшение объема гиппокампа может объяснять патологически сниженное настроение.
Механизмы регуляции нейропластичности на фоне депрессивных расстройств
 Рис.12
Рис.12
Важным регуляторов процессов нейропластичности является мозговой нейротрофический фактор (BDNF — brain derived neurotrophic factor), уровни которого снижаются на фоне стресса и депрессии.
Отрицательным регуляторами нейропластичности могут выступать и гормоны стресса, например кортизол — глюкокортикостероид, вырабатываемый корой надпочечников. Хорошо известно, что большинство применяемых антидепрессантов (при хроническом применении) способны повышать уровни BDNF и, по-видимому, это является частью их терапевтического действия.
Свойства мозгового нейротрофического фактора (BDNF*) и перспектива его применения в качестве антидепрессанта
 Рис.13. Castrén E., Rantamäki T. The role of BDNF and its receptors in depression and antidepressant drug action: Reactivation of developmental plasticity // Developmental Neurobiology. 2010. 70(5). P. 289–97.
Рис.13. Castrén E., Rantamäki T. The role of BDNF and its receptors in depression and antidepressant drug action: Reactivation of developmental plasticity // Developmental Neurobiology. 2010. 70(5). P. 289–97.
*BDNF играет важную роль при многих психопатологиях, в т.ч. и депрессиях. Применение самого BDNF невозможно ввиду целого ряда причин (которые перечислены на рисунке).
Помимо антидепрессантов существуют и другие факторы, способствующие повышению уровней BDNF в ЦНС и они совпадают с положительными стимулами нейропластичности — обучение, физические упражнения, новый опыт, диета и т.д. Более того, зачастую эти факторы могут дополнять лекарственную терапию депрессивных расстройств.
На рисунке 14 представлены данные об исследовании антидепрессивных свойств самого BDNF на животных моделях (крысах). Поскольку сам BDNF не может проникать в мозг (через гематоэнцефалический барьер) при периферическом введении, то в экспериментах BDNF вводили непосредственно в мозг.
Изучение антидепрессивных свойств мозгового нейротрофического фактора (BDNF) на животных моделях
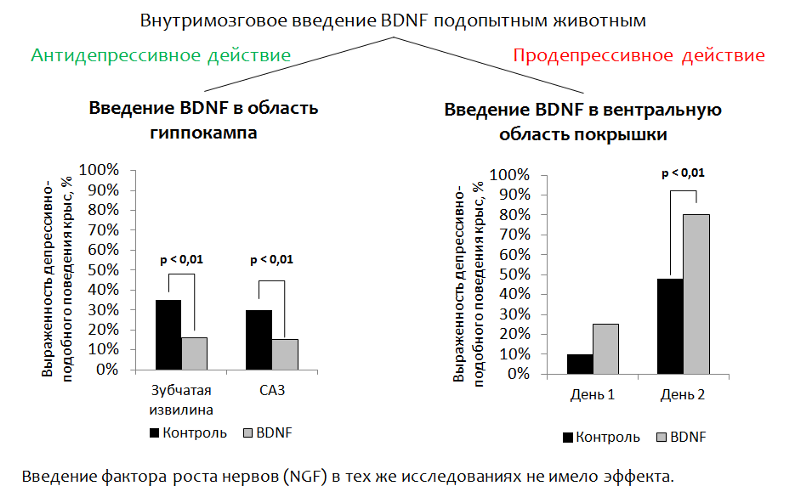 Рис.14 Eisch A.J., Bolaños C.A., de Wit J. et al. Brain-derived neurotrophic factor in the ventral midbrain-nucleus accumbens pathway: a role in depression // Biological Psychiatry. 2003. 54(10). P. 994–1005; Shirayama Y., Chen A.C., Nakagawa S., Russell D.S., Duman R.S. Brain-derived neurotrophic factor produces antidepressant effects in behavioral models of depression. Journal of Neuroscience. 2002. 22(8). P. 3251–61.
Рис.14 Eisch A.J., Bolaños C.A., de Wit J. et al. Brain-derived neurotrophic factor in the ventral midbrain-nucleus accumbens pathway: a role in depression // Biological Psychiatry. 2003. 54(10). P. 994–1005; Shirayama Y., Chen A.C., Nakagawa S., Russell D.S., Duman R.S. Brain-derived neurotrophic factor produces antidepressant effects in behavioral models of depression. Journal of Neuroscience. 2002. 22(8). P. 3251–61.
1. Введение в область гиппокампа. Основная идея заключалась в адресном введении BDNF в область мозга, ответственную за нейрогенез (зубчатая извилина гиппокампа — одна из так называемых «нейрогенных ниш»). После введения оценивали депрессивно-подобное поведение животных. *(Оценивают дисфорический компонент депрессии. Животных (крысы или мыши) помещают в цилиндр с водой, из которого самостоятельно выбраться невозможно. Через некоторое время активные попытки животного выбраться из цилиндра сменяются «состоянием отчаяния» (животное находится в воде практически без движений.) *
Сокращение неподвижности (иммобилизации) животного рассматривают как коррелят антидепрессивного эффекта. BDNF оказывал антидепрессивный эффект после введения в зубчатую извилину (нейрогенная ниша) и СА3 зону гиппокампа (нейроны этой зоны обеспечивают взаимодействие зубчатой извилины с другими областями гиппокампа).
2. При введения BDNF в вентральную область покрышки (зону, ответственную продукцию дофамина и страдающую при депрессивных расстройствах) был зарегистрирован обратный эффект — усиление депрессивно-подобного поведения.
Миметики
Поскольку не представляется возможным использование самого BDNF в качестве лекарственного средства, то разрабатывают препарат на основе этого фактора. В частности, были хорошо изучены активные участки молекулы BDNF (пространственная структура которых, обуславливает название — петля. Рис. 15).
В настоящее время активно изучаются миметики (вещества, имитирующие активность) BDNF.
Разработка препаратов нового поколения на основе мозгового нейротрофического фактора (BDNF)
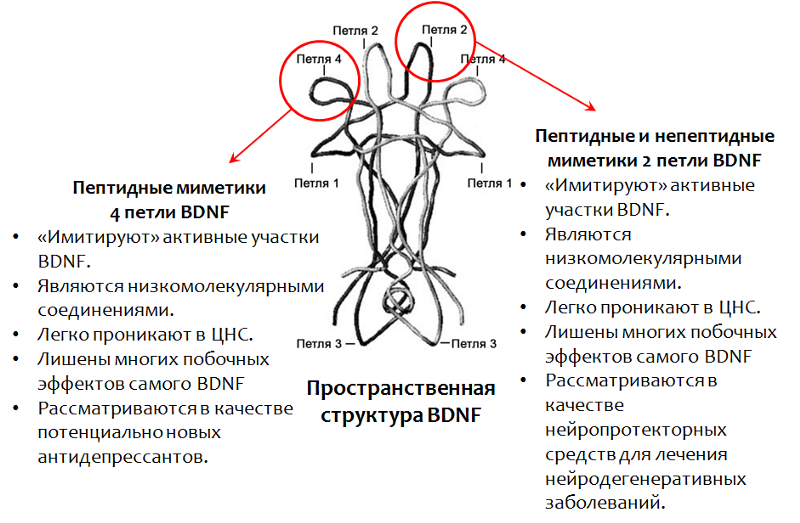 Рис.15. Fletcher J.M., Morton C.J., Zwar R.A. et al. Design of a conformationally defined and proteolytically stable circular mimetic of brain-derived neurotrophic factor // The Journal of Biological Chemistry. 2008. 283(48). P. 33375–83. Massa S.M., Yang T., Xie Y. et al. V Small molecule BDNF mimetics activate TrkB signaling and prevent neuronal degeneration in rodents // The Journal of Clinical Investigation. 2010. 120(5). P. 1774–85. Середенин С.Б., Воронина Т.А., Гудашева Т.А. и др. Антидепрессивный эффект оригинального низкомолекулярного миметика BDNF, димерного дипептида ГСБ-106 // Acta Naturae. 2013. 4(19). P. 116–120.
Рис.15. Fletcher J.M., Morton C.J., Zwar R.A. et al. Design of a conformationally defined and proteolytically stable circular mimetic of brain-derived neurotrophic factor // The Journal of Biological Chemistry. 2008. 283(48). P. 33375–83. Massa S.M., Yang T., Xie Y. et al. V Small molecule BDNF mimetics activate TrkB signaling and prevent neuronal degeneration in rodents // The Journal of Clinical Investigation. 2010. 120(5). P. 1774–85. Середенин С.Б., Воронина Т.А., Гудашева Т.А. и др. Антидепрессивный эффект оригинального низкомолекулярного миметика BDNF, димерного дипептида ГСБ-106 // Acta Naturae. 2013. 4(19). P. 116–120.
Антидепрессивные свойства пептидного миметиков 4 петли мозгового нейротрофического фактора (BDNF) — соединения ГСБ-106
 Рис. 16. Середенин С.Б., Воронина Т.А., Гудашева Т.А. и др. Антидепрессивный эффект оригинального низкомолекулярного миметика BDNF, димерного дипептида ГСБ-106 // Acta Naturae. 2013. 4(19). P. 116–120.
Рис. 16. Середенин С.Б., Воронина Т.А., Гудашева Т.А. и др. Антидепрессивный эффект оригинального низкомолекулярного миметика BDNF, димерного дипептида ГСБ-106 // Acta Naturae. 2013. 4(19). P. 116–120.
ГСБ-106 — вещество пептидной структуры, представляет собой миметик 4 петли BDNF (отечественная разработка). Вещество оказывает антидепрессивный эффект на животных моделях при различных режимах введения. В настоящее время проводятся расширенные исследования фармакологических свойств этого соединения с целью создания на его основе антидепрессанта нового поколения.
Нейрогенез* и депрессия
*Нейрогенез — многоступенчатый процесс образования новых нервных клеток в зрелой ЦНС, являющийся адаптивной функцией нервной системы.
 Fuchs E., Flügge G. Adult Neuroplasticity: More Than 40 Years of Research // Neural Plasticity. 2014. Article ID 541870, doi:10.1155/2014/541870
Fuchs E., Flügge G. Adult Neuroplasticity: More Than 40 Years of Research // Neural Plasticity. 2014. Article ID 541870, doi:10.1155/2014/541870
 Рис. 17
Рис. 17
На рисунке 17 мы показываем нейрогенные зоны (ниши) млекопитающих:
- Зубчатая извилина гиппокампа
- Обонятельные луковицы
- Субвентрикулярная зона
Считается, что у человека основной нейрогенной нишей является гиппокамп (зубчатая извилина).
Стресс, который рассматривается в качестве одного из главных пусковых стимулов депрессивных расстройств, приводит к снижению уровней BDNF и повышению кортизола, который, в свою очередь, усиливает действие глутамата на ЦНС.
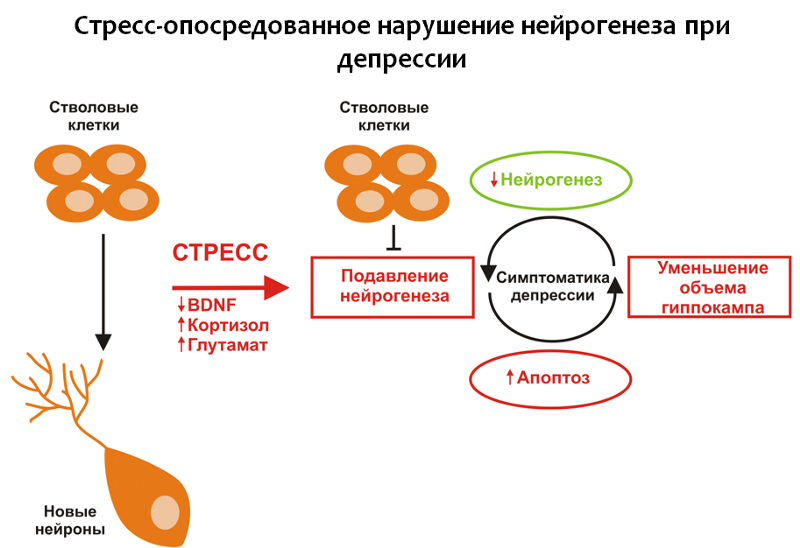 Рис. 18
Рис. 18
Эти изменения, в совокупности, подавляют гиппокампальный нейрогенез и приводят к уменьшению объема гиппокампа. Под действием глутамата так же возможна активация апоптоза (программируемой гибели нервных клеток). При нарушении нейрогенеза мозг не может в полной мере восполнить потери и развивается депрессивная симптоматика.
Глутамат — одна из основных возбуждающих аминокислот ЦНС. Нарушение нейропластичности под влиянием чрезмерного действия глутамата, по-видимому, связано с компенсаторной реакцией. Нейроны «убирают» лишние связи и гибнут (апоптоз), чтобы защитить ЦНС от перевозбуждения и последующих повреждающих последствий этого процесса.
Хорошо известным фактом является способность антидепрессантов стимулировать нейрогенез, однако механизмы, лежащие в основе этого явления, на сегодняшний день до конца не изучены. Известно, что все группы антидепрессантов действуют на моноаминовую систему головного мозга и восполняют функциональный или материальный дефициты серотонина и норадреналина. Кроме того, препараты данной фармакологической группы повышают уровни мозгового нейротрофического фактора.
Антидепрессанты способны стимулировать нейрогенез
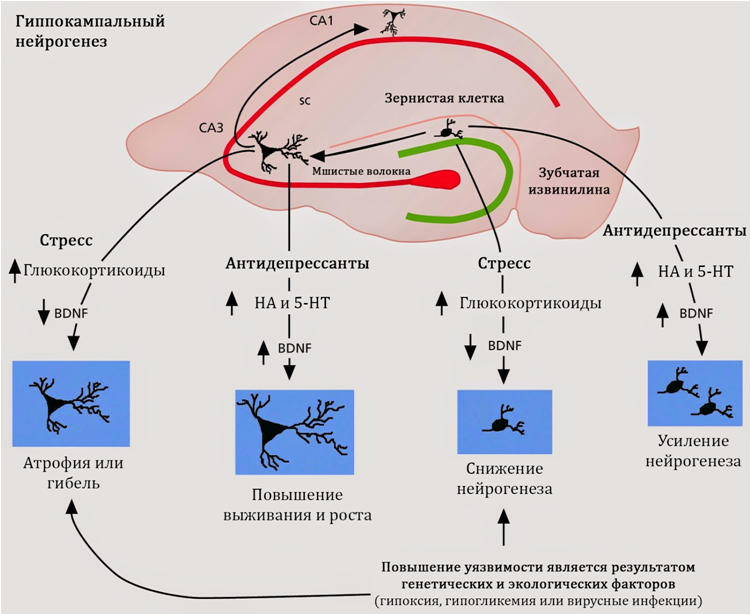 Рис. 19
Рис. 19
Стимуляция нейрогенеза характерна для антидепрессантов независимо от их механизма действия, химического строения или класса. Следовательно, поиск механизмов регуляции нейрогенеза следует осуществлять в общих для всех антидепрессантов свойствах. Таким общими свойствами является активность антидепрессантов в отношении серотонина и норадреналина.
На сегодняшний день формируется представление о роли серотонина в регуляции гиппокампального нейрогенеза.
Возможные механизмы нейрогенной активности антидепрессантов
 Рис. 20. Alenina N., Klempin F. The role of serotonin in adult hippocampal neurogenesis. Behavioural Brain Research. 2015. 277. P. 49–57.
Рис. 20. Alenina N., Klempin F. The role of serotonin in adult hippocampal neurogenesis. Behavioural Brain Research. 2015. 277. P. 49–57.
Во-первых, зубчатая извилина гиппокампа получает серотониновую регуляцию от больших ядер шва (скопление нервных клеток, которые вырабатывают серотонин; располагаются в стволе мозга) как напрямую, так и через вставочные нейроны, которые несут на своей поверхности различные подтипы серотониновых рецепторов.
Во-вторых, на самих стволовых клетках обнаружены серотониновые рецепторы 1А подтипа, что говорит о потенциальной возможности серотонина регулировать стволовые клетки мозга.
Механизмы нейрогенной активности антидепрессантов
 Рис. 21
Рис. 21
Как было показано в экспериментальных исследованиях (на животных и культурах клеток), селективные ингибиторы обратного захвата серотонина (СИОЗС, классический препарат из этой группы — флуоксетин) способны стимулировать стадию пролиферации нейрогенеза в гиппокампе.
Предполагаемый механизм — повышение концентрации серотонина (5-НТ — серотонин, он же 5-гидрокситриптамин) в ЦНС и последующая (усиленная) стимуляция серотонином нейрогенеза.
Потенциальными мишенями антидепрессантов в процессе нейрогенеза также могут служить серотониновые рецепторы 1А подтипа (5НТ1А-рецепторы). Эти предположения согласуются с данными о положительном (терапетивческом) эффекте активации серотониновых 5-НТ1А-рецепторов антидепрессантами (например, вилазодоном) на фоне депрессивных расстройств.
Еще одним аргументом, который позволяет рассматривать стимуляцию нейрогенеза как основной механизм действия антидепрессантов, является совпадение во времени между средним временем наступления терапевтического эффекта (от 2 до 7 недель) и полным циклом нейрогенеза (3–7 недель).
Помимо перечисленных механизмов, антидепрессанты из группы СИОЗС также демонстрируют способность повышать уровни BDNF, однако механизмы этого эффекта остаются неизвестными.
Влияние флуоксетина (прозака) на нейрогенез нечеловекоподобных приматов
 Рис. 22. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Рис. 22. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
В исследованиях на приматах (наиболее релевантная животная модель) показана способность флуоксетина (торг. название «прозак») стимулировать нейрогенез на фоне стресса (в данном случае была использована модель изоляционного стресса). На рисунке 22 показано, что флуоксетин значительно увеличивал (статистически достоверно) скорость пролиферации (деления) стволовых нервных клеток в гиппокампе приматов.
Влияние флуоксетина на нейрогенез нечеловекоподобных приматов
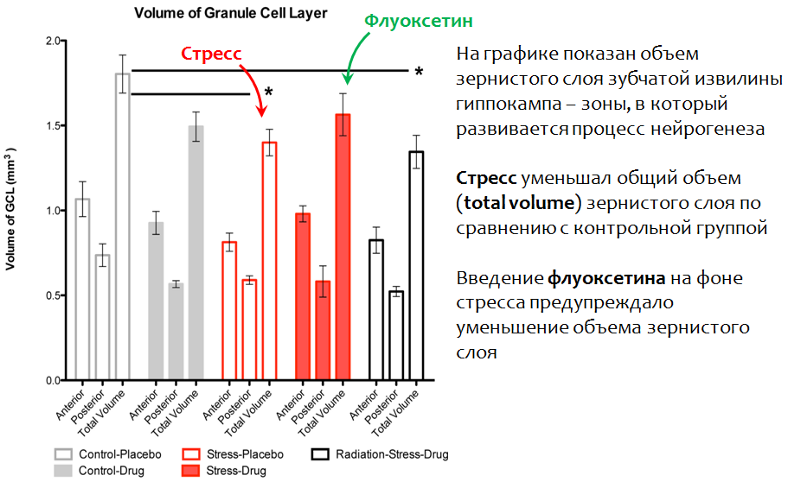 Рис. 23. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Рис. 23. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Воздействие стресса приводило к уменьшению зернистого слоя зубчатой извилины гиппокампа — основной нейрогенной зоны мозга приматов. Введение флуоксетина на фоне стрессовой экспозиции предупреждало это изменение и сохраняло нормальной объем этой структуры (общий объем).
Влияние флуоксетина на нейрогенез нечеловекоподобных приматов
Корреляция между ангедонией (депрессивно-подобным поведением) и нейрогенезом
 Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates. PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates. PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Было установлено наличие корреляции между стимуляцией нейрогенеза флуоксетином и предупреждением развития депрессивного поведения (ангедонии).
При изучении влияния флуокситина на нейрогенез нечеловекоподобных приматов была установлена достоверная корреляция между снижением нейрогенеза (вызванного стрессом) и усилением депрессивно-подобного поведения приматов (ангедония, которую определяли по совокупности нарушений социального и пищевого поведения), а также корреляция между стимуляцией нейрогенеза флуоксетином и отсутствием депрессивно-подобного поведения.
Норадреналин — другой важный моноамин, который наравне с серотонином способен принимать участие в регуляции гиппокампального нейрогенеза.
Возможные механизмы нейрогенной активности антидепрессантов
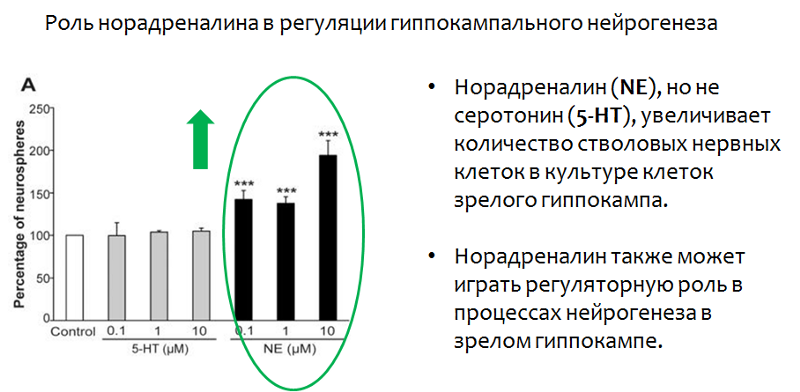 Рис.25. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
Рис.25. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
В исследованиях на культурах нейронов гиппокампа было показано, что норадреналин, (в отличие от серотонина) повышал количество стволовых клеток. Серотонин же, как было продемонстрировано ранее, влиял не на количество, а на скорость пролиферации.
Помимо количественных изменений норадреналин вызывал и качественные — увеличивал размеры нейросфер, что наглядно показано на снимке электронного микроскопа (см. рис.26).
Возможные механизмы нейрогенной активности антидепрессантов
 Рис. 26. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
Рис. 26. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
Роль глиальных клеток в формировании депрессивных расстройств
Ранее нами были рассмотрены изменения в нейронах, но проигнорирована роль глиальных клеток в формировании депрессивных расстройств. Тем не менее, экспериментальные и клинические исследования указывают на возможную роль патологии глиальных клеток в патогенезе депрессии.
Роль глии в формировании депрессивных расстройств
 Рис. 27. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 27. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Исследователями была представлена схема патогенеза депрессивных расстройств при участии глии (Рис. 27).
Генетическая предрасположенность может включать: наследственный фактор (наличие депрессивного расстройства у одного из родителей повышает риск этого заболевания у ребенка); полиморфизм генов: BDNF, серотонинового переносчика (который участвуют в обратном захвате серотонина в нервные и глиальные клетки), серотониновых рецепторов, ферментов синтеза серотонина (триптофан гидроксилазы 2 типа).
Генетическая уязвимость в совокупности с экологическими и стрессовыми факторами создает благоприятную среду для формирования депрессивного расстройства.
Учеными было установлено, что роль глиальных клеток неодинакова у молодых и пожилых больных (Рис. 28). Глиальные клетки могут играть важную роль в патогенезе ранних стадий депрессивных расстройств, которые могут обуславливать выраженное уменьшение количества пирамидных нейронов в более зрелом возрасте.
Роль глиальных клеток в формировании депрессивных расстройств неодинакова у молодых и пожилых больных
 Рис. 28. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 28. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
В частности, потеря функции глиальных клеток в молодом возрасте повышает риск развития повторных эпизодов депрессии в пожилом возрасте, но при этом будет преобладать уже дефицит пирамидных нейронов, а не глиальных клеток.
 Рис. 29. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 29. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Подобная динамика согласуется с одной из важнейших функций глиальных клеток — поглощением избытка глутамата из синаптической щели (контакта между нервными клетками). Глутамат является одним из основных возбуждающих нейромедиаторов ЦНС и его чрезмерное действие может приводить к нарушению нейропластичности и эксайтотоксичности (нейротоксичность, связанная с избыточным возбуждением; по-видимому, является защитной реакцией нервных клеток от перевозбуждения — количество нейронов и связей между ними уменьшается).
В глиальных клетках находится белок-транспортер, который участвует в переносе глутамата из синаптической щели в глиальную клетку, где глутамат подвергается метаболизму.
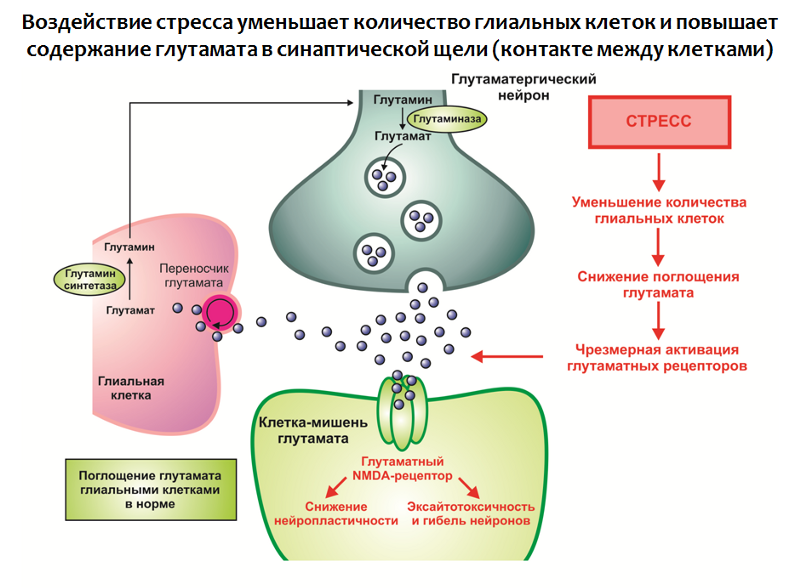 Рис. 30. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 30. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Воздействие стресса в совокупности с другими факторами приводит к:
- Уменьшению количества глиальных клеток в структурах лимбической системы мозга;
- Гиперпродукции глутамата.
Таким образом формируется избыток этого возбуждающего нейромедиатора, который является отрицательным модулятором нейропластичности (как полагают, это может быть частью компенсаторной реакции, защищающей нервную систему от перевозбуждения).
Функция глиальных клеток не ограничивается поглощением глутамата, они также участвуют в выработке нейротрофинов, в частности BDNF (рис.31).
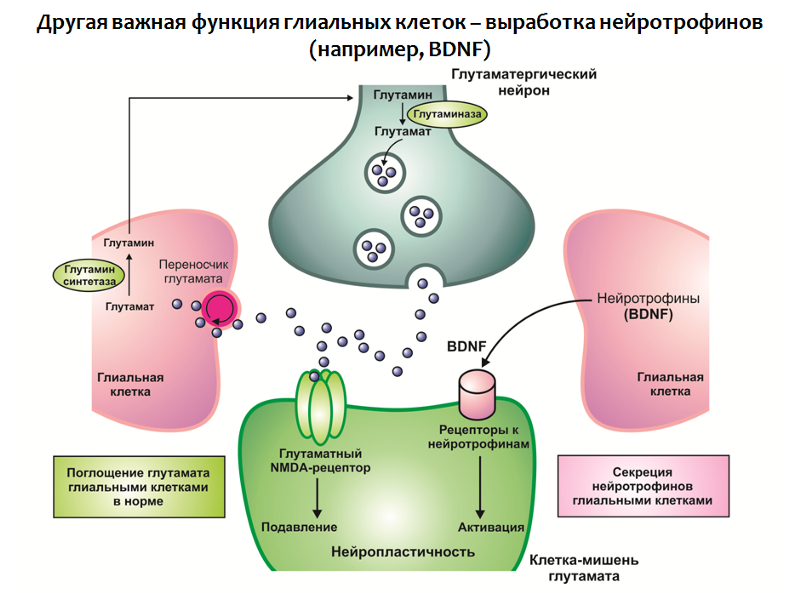 Рис. 31
Рис. 31
В совокупности дефицит нейротрофинов и избыток глутамата приводят к нарушению нейропластичности и деперссивно-подобным изменениям (уменьшению объема гиппокампа и префронтальной коры, нарушению нормальной функциональной связи между структурами лимбического круга).
В контексте данной концепции также возможно найти объяснения терапевтической эффективности антидепрессантов (Рис. 32):
- Антидепрессанты способны «смягчать» действие стресса за счет нормализации активности гипоталамо-гипофизарно-надпочечниковой оси;
- Увеличивать концентрации BDNF в ЦНС;
- Стимулировать процессы нейропластичности.
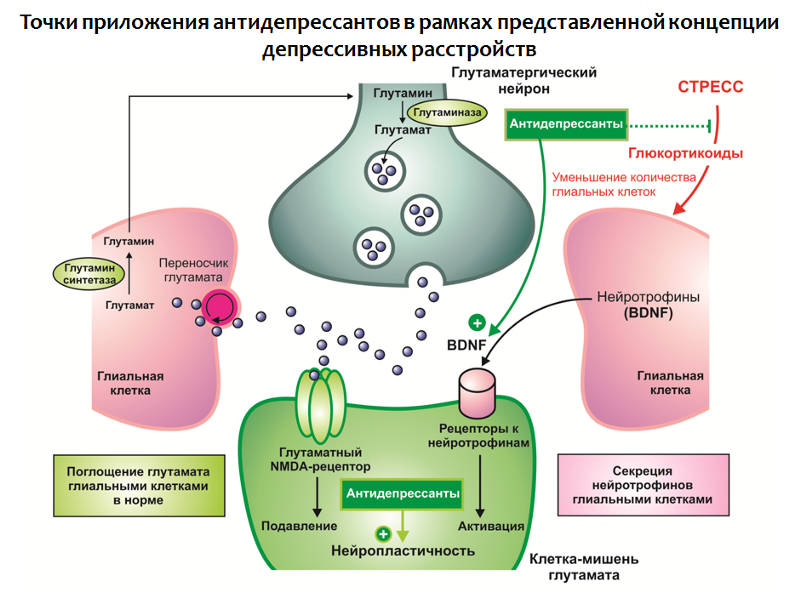 Рис. 32
Рис. 32
На рисунке 33 представлена обобщенная схема депрессивных расстройств, которая построена на концепции стресс-опосредованной нейродегенерации. Видно, что антидепрессанты занимают нишу «корректоров последствий стресса». При всех имеющихся достоинствах и терапевтическом потенциале, антидепрессанты оказываются не всегда эффективны в устранении депрессивной симптоматики.
 Рис. 33
Рис. 33
Существуют, так называемые, резистентные к фармакотерапии формы депрессивных расстройств. Этот феномен пытаются объяснить и разнообразностью стрессовых факторов, и различной силой и продолжительностью стрессовой экспозиции, и индивидуальными особенностями (мутация мишеней антидепрессантов). Но общий вывод из данной ситуации один — необходим поиск принципиально новых мишеней для фармакотерапии депрессивных расстройств.
Новые тенденции в создании антидепрессантов
Перспективным направлением представляется воздействие на систему глутамата, если рассматривать этот нейромедиатор как один из ключевых элементов патогенеза депрессивных расстройств. В рамках этого направления получены значительные успехи — создан принципиально новый антидепрессант, который по своему механизму является блокатором глутаматный NMDA-рецепторов и препятствует чрезмерной активности этой аминокислоты. Антидепрессант Rapasintel в настоящее время успешно прошел I и II фазы клинических исследований, где показал высокую эффективность и рассматривается как средство лечения устойчивых форм депрессивных расстройств.
В рамках глутаматергической теории депрессивных расстройств можно рассмотреть и роль основного тормозного медиатора ЦНС — гамма-аминомасляной кислоты (ГАМК или GABA).
 Рис. 34. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
Рис. 34. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
ГАМК является функциональной противоположностью глутамата и способна ограничивать его возбуждающее действие, поэтому оценка роли ГАМК в депрессивных расстройствах представляется вполне логичной.
Установлено, что на фоне депрессивных расстройств наблюдается дефицит корковых уровней ГАМК и ее рецепторов. В частности, пирамидные нейроны, вырабатывающие глутамат, могут подвергаться тормозному влиянию интернейронов, вырабатывающих ГАМК. ГАМК реализует свое тормозное действие посредством активации ГАМК-А-рецептора.
 Рис. 35. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
Рис. 35. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
Структура ГАМК-А рецептора представлена на рисунке 35. Рецептор состоит из 5 субъединиц (2α, 2β и γ), каждая субъединица имеет подтип, например известно 6 вариантов α-субъединиц. Комбинация различных вариантов субъединиц определяет подтип ГАМК-А рецептора.
В подтверждение роли ГАМК говорит и эффективность положительного модулятора ГАМК-А рецептора — эсзопиклона. Мишенью данного препарата являются ГАМК-А рецепторы, несущие в своем составе α2– и α3-субъединицы.
Эсзопиклон
иногда применяется в комбинации с антидепрессантами и значительно облегчает депрессивную симптоматику даже после отмены антидепрессантов. Предполагают, что его терапевтическое действие связано с ослаблением функции глутамата. Интересно, что другие положительные модуляторы ГАМК-А рецептора (для которых необходимо наличие других вариантов α субъединиц, например золпидем) подобной активностью не обладают.
 Рис. 36
Рис. 36
И так, в представленной схеме (Рис. 37) мы резюмируем данные о нарушении процессов нейропластичности и развитии депрессивной симптоматики.
- Подавление процессов нейропластичности не является строго специфичным для депрессивных расстройств, а наблюдается и при других психопатологиях (шизофрения, биполярное аффективное расстройство) и неврологических заболеваниях (рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера).
- На животных моделях подавление пролиферации стволовых клеток химическими агентами не блокирует эффекты антидепрессантов (в отличие от рентгеновских лучей, где отмечен обратный эффект).
- Ресурс нейрогенеза может оказаться ограниченным, и чрезмерная стимуляция может привести к истощению.
- Неизвестны долгосрочные последствия длительной искусственной стимуляции нейрогенеза. Существует ли риск развития опухолевого процесса?
- Нарушение нейропластичности не является исчерпывающей концепцией депрессивных расстройств. Концепция не может в полной мере объяснить наличие ВСЕХ симптомов заболевания (например, соматизации депрессивной симптоматики, когда симптомы депрессии маскируются под заболевания внутренних органов — головная боль, боль в сердце, в животе и т.д.), характера течения (цикличность) и резистентностью некоторых форм депрессий к лекарственной терапии (несмотря на то, что антидепрессанты активируют нейрогенез и повышают BDNF).
Нарушение процессов нейропластичности и депрессивные расстройства — недостатки концепции
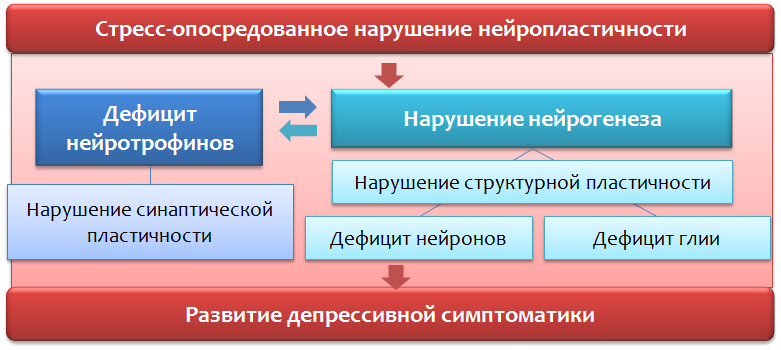 Рис. 37
Рис. 37
— Подавление процессов нейропластичности не является специфичным для депрессивных расстройств
— На животных моделях подавление пролиферации стволовых клеток не всегда блокирует эффекты антидепрессантов
— Ресурс нейрогенеза может оказаться ограниченным, и чрезмерная стимуляция может привести к истощению.
— Неизвестны долгосрочные последствия длительной «насильственной» стимуляции нейрогенеза. Существует ли риск развития опухолевого процесса?
— Нарушение нейропластичности не является исчерпывающей концепцией депрессивных расстройств.
Теории о роли нейромедиаторных аминокислот — глутамата и ГАМК, не являются исчерпывающими. Во-первых, представленные системы (глутаматергическая и ГАМКергическая) не могут быть рассмотрены изолированно от других факторов, т.к. по сути, являются промежуточным звеном патогенеза депрессивных расстройств или отдельных симптомов. Во-вторых, изменения в глутаматергической и ГАМКергической системах мозга наблюдаются не только при депрессивных, но и ряде других расстройств и состояний (шизофрения, тревожные расстройства, панические атаки, эпилепсия, болевая чувствительность, болезнь Паркинсона, болезнь Альцгеймера).
 Рис. 38
Рис. 38
Если рассматривать фармакологическое вмешательство в глутаматергическую систему, то оно, несомненно, перспективно и даже инновационно, т.к. ранее все антидепрессанты действовали исключительно на моноаминегическую систему мозга. Однако, столь широкий функционал глутамата в ЦНС может привести к развитию нежелательных эффектов и ряду противопоказаний. Но рано давать прогнозы, блокатору глутаматных рецепторов еще предстоит пройти III фазу клинических исследований. Препарат рассматривается не как замена современным антидепрессантам, а как средство дополнительной терапии (например, при устойчивых формах депрессий).
Препараты, являющиеся позитивным модуляторами ГАМКа-рецепторов, в настоящее время не рассматриваются как самостоятельные антидепрессанты, они полезны в устранении отдельных симптомов депрессивных расстройств.
«Идеальный» препарат
Перспективным направлением для разработки новых эффективных и безопасных антидепрессантов представляется изучение механизмов самого стресса, поскольку именно стрессовый фактор (стрессовые события) рассматривается в качестве основного пускового стимула для формирования депрессивных расстройств.
Как должен выглядеть перспективный препарат?
В основе поиска и создания «идеального» антидепрессанта должно лежать два простых принципа (согласно Franco Borsini):
- Препарат не должен изменять психику здорового человека
- Препарат должен действовать только в условиях психопатологии
 Рис. 39. Borsini F. Models for depression in drug screening and preclinical studies: Future directions // World Journal of Pharmacology. 2012. 1(1). P. 21–29.
Рис. 39. Borsini F. Models for depression in drug screening and preclinical studies: Future directions // World Journal of Pharmacology. 2012. 1(1). P. 21–29.
Прерывание механизмов стресса на ранних этапах позволило бы предотвратить все те изменения, которые рассматривались в контексте нашей статьи. Именно такой способ коррекции, в теории, представляется наиболее эффективным не только для предупреждения развития депрессии, но и для надежной защиты от рецидивов и повторных, более тяжелых эпизодов.
Лекарственная терапия, сама по себе, не является единственным средством коррекции рассматриваемой психопатологии. Не меньшее значение должно уделяться и общению с пациентами, выявлению причины заболевания. В ряде случаев, эффективность психотерапии также имеет высокий потенциал, т.к. помогает найти пути решения проблемы, а не борется с симптомами заболевания, оставляя проблему не решенной и переводя депрессию в субхроническую и хроническую формы.
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России