Опухоль: «заморить голодом»
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
О том, что раковые клетки вырабатывают энергию не так, как это делают нормальные, ученые знают с 20-х годов ХХ века. Этот феномен назван «эффектом Варбурга» (Warburg effect) по имени ученого, описавшего его первым – немецкого биохимика Отто Варбурга. Однако метаболизм раковых клеток в значительной степени перестал быть областью исследований с 70-х годов, когда ученые вплотную занялись исследованием вновь открытых генов, вызывающих рак.
Теперь новое поколение исследователей уделяет внимание странному и, казалось бы, неэффективному метаболизму раковых клеток, который тесно связан с большинством генов, участвующих в развитии рака.
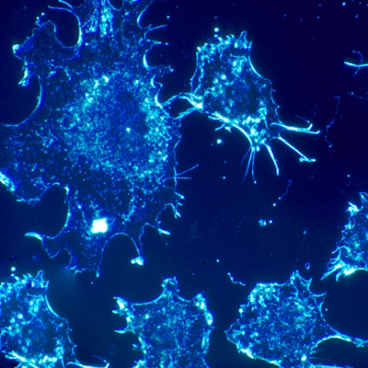
Недавние открытия позволяют предположить, что раковые клетки генетически перепрограммируют свои пути выработки энергии для создания строительных блоков, необходимых им для бесконтрольного роста и размножения, растрачивая большую часть энергии на этот процесс. «Потенциальные лекарства, блокирующие этот путь, могут стать новым средством для лечения целого ряда раковых заболеваний», – считает Мэтью Вандер Хайден (Matthew Vander Heiden), адъюнкт-профессор биологии и сотрудник Научно-исследовательского института рака Дэвида Коха (David H. Koch Institute for Integrative Cancer Research) Массачусетского технологического института (Massachusetts Institute of Technology).
Всем опухолям приходится смещать метаболизм по мере их пролиферации, – говорит Вандер Хайден. – Если мы сможем помешать этому, у нас есть шанс изменить ситуацию во многих типах опухолей.
Вандер Хайден занимается изучением одного из ключевых ферментов, задействованного в метаболических путях раковых клеток, известного как пируваткиназа М2, имея ввиду разработку лекарственных препаратов, способных изменить его активность и эффективно «заморить голодом» раковые клетки, лишив их необходимых для роста и размножения веществ.
В качестве источника энергии клетки человеческого организма используют сахара, разрушая их в ходе серии сложных химических реакций, требующих кислорода. Варбург открыл, что опухолевые клетки переключаются на менее эффективную метаболическую стратегию, известную как брожение, для которой не требуется кислород, но вырабатывающую гораздо меньше энергии.
Неэффективно сжигая топливо, раковые клетки потребляют гораздо больше глюкозы, чем обычные. Ученые используют этот факт для позитронно-эмиссионного (PET) сканирования, отслеживающего метаболизм глюкозы как диагностического инструмента для выявления начала процесса распространения опухоли.
После открытия Варбурга ученые в течение несколько десятилетий, с 30-х до 90-х годов ХХ века, пытались выяснить биохимию метаболизма рака. Но в 70-х годах открытие генов, вызывающих рак (онкогенов), и генов, подавляющих его развитие, привело к «осознанию того, что рак – генетическое, а не метаболическое заболевание, такие как диабет или ожирение», говорит Льюис Кэнтли (Lewis Cantley), профессор системной биологии Гарвардской медицинской школы (Harvard Medical School).
Однако интерес к метаболизму раковых клеток увеличивался, особенно в последние несколько лет, по мере накопления доказательств того, что многие из онкогенов играют роль в его переключении.
Мир ученых, занимающихся исследованием рака, полон исследователей, изучающих ген Ras (способный вызвать рак в случае возникновения в нем мутации), ген р53 (супрессор рака) и все эти различные сигнальные и генетические явления, – говорит Вандер Хайден. – Все они, так или иначе, связаны с метаболизмом.
Возрождение исследований в области метаболизма рака постепенно началось в 1990-х годах, когда Вандер Хайден был аспирантом в Университете Чикаго (University of Chicago). Здесь он работал с Крейгом Томпсоном (Craig Thompson), одним из пионеров возрожденной области. Скоро Вандер Хайден понял, что «существует много такого, чего мы не понимаем о метаболизме, о котором как будто бы забыли».
После получения степени доктора философии и медицины Вандер Хайден уехал в лабораторию Кэнтли в Гарварде, где он изучал пируваткиназу М2 (ПКМ2), контролирующую ключевое звено в процессе брожения. В 2008 году Вандер Хайден, Кэнтли и другие ученые из Гарвардской медицинской школы сообщили в журнале Nature, что, когда метаболизм клеток смещается от нормального к «варбургскому», они начинают использовать ПКМ2 вместо пируваткиназы М1, фермента, который большинство взрослых клеток используют в процессе гликолиза (первого этапа расщепления глюкозы при получении энергии).
Большим преимуществом потенциальных лекарственных препаратов, интерферирующих с ПКМ2, является то, что фермент не обнаружен в нормальных взрослых клетках, что может устранить побочные эффекты, свойственные существующим противораковым препаратам, считает Селесте Саймон (Celeste Simon), профессор клеточной и эволюционной биологии Университета Пенсильвании (University of Pennsylvania).
Большой проблемой в онкологии нескольких последних десятилетий является то, что подавляющее количество препаратов, к несчастью, имеют побочные эффекты, что ограничивает назначаемые пациентам дозы и оказывает отрицательное влияние на качество жизни, – говорит Саймон.
Компания, одним из основателей которой является Кэнтли, сейчас разрабатывает лекарственный препарат, предназначенный для воздействия на ПКМ2. (Вандер Хайден – научный консультант компании Agios Pharmaceuticals).
Однако ПКМ2 не единственная возможная мишень для лекарственных препаратов, считает Кэнтли.
Многие находят метаболические ферменты привлекательной моделью для лекарственной терапии, так как их очень много, – говорит он.
- empirv's блог
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России