Перспективы гипертермии раковых опухолей: «горячие точки» вызывают стресс и гибель клеток
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Забудьте о хирургии. Для борьбы с раком группа ученых из Государственного университета штата Канзас (Kansas State University) изучает гипертермию, индуцированную наночастицами.
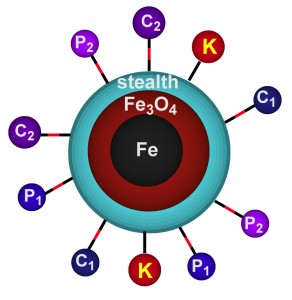
Группа профессора анатомии и физиологии Дерила Тройера (Deryl Troyer), включающая в себя представителей разных научных дисциплин, использует наночастицы из железа и его оксида для нагревания и перфорации мембран раковых клеток, вызывающих их гибель, с 2007 года. Кроме того, разработанные учеными наночастицы связаны с диагностическим красителем. Когда краска высвобождается из электронной сферы наночастиц, она покрывает другие раковые ткани по всему организму, что облегчает их обнаружение.
Группа профессора Тройера сотрудничает с NanoScale Corporation, манхэттенской компанией, занимающейся разработкой и коммерциализацией передовых технологий, материалов и продуктов.
Исследование, проведенное на мышах, в настоящее время рассматривается в качестве кандидата на доклинические испытания. Профессор химии Стэфан Боссманн (Stefan Bossmann) из группы Тройера очень оптимистично смотрит на то, что этот метод сможет дать больным раком пациентам.
«Это значит, что существует шанс в течение следующего десятилетия получить недорогой метод лечения рака с более высокой вероятностью успеха, чем может гарантировать химиотерапия», – говорит он. «У нас очень много схем лечения терапевтическими препаратами, которые безумно дороги. Типичный больной раком пациент тратит миллион долларов только на лекарственные средства, а лечение нашим методом будет обходиться примерно в десять раз дешевле. Наши методы – это физические методы. Раковые клетки не могут развить резистентность к физическим методам», – подчеркивает Боссманн. «Они могут стать резистентными к химиотерапии, но не могут противостоять вызывающему их гибель нагреванию».
На первый взгляд нагревание или перфорация раковых клеток может показаться странным методом лечения, но после поглощения раковыми клетками наночастицы действуют с чрезвычайной точностью и слаженностью.
«Доставка наночастиц в раковую ткань очень напоминает рыбалку», – сравнивает Боссманн. «У нас есть удочка с наночастицей – очень привлекательной приманкой, которую рак хочет сожрать, как рыба червяка».
Приманкой, разработанной учеными, является слой органического материала, привлекающий раковые клетки к наночастицам. Покрытие наночастицы включается в процесс их метаболизма. В дополнении к своей функции приманки органический слой служит и механизмом для маскировки от защитных сил организма, которые в противном случае разрушили бы чужеродный объект.
Попав в раковую клетку, наночастица, состоящая из металлического железного ядра, покрытого слоем оксида железа и органическим веществом, приступает к работе. Переменное магнитное поле заставляет частицу вырабатывать тепло, вызываемое трением, которое передается окружающим ее белкам, липидам и воде раковых клеток, создавая небольшие участки перегрева.
«При достаточном количестве таких «горячих точек» клетка перегревается до смерти, а здоровая ткань остается нетронутой», – объясняет Боссманн.
Если участки перегрева не сконцентрированы, тепло разрушает белки или липидные структуры, растворяя клеточную мембрану. Образование бреши в мембране вводит раковую клетку в состояние стресса, приводящего к ее гибели.
«Клетке может хватить даже небольшого стресса», – утверждает Боссманн.
Краситель внутри электронной сферы каждой наночастицы разносится ферментами и используется для обнаружения раковой ткани по всему организму.
«В будущем кто-то мог бы разработать специальный анализ крови, так как часть этих ферментов попадает в систему кровообращения. Тогда лет через пять или около того мы могли бы взять у пациента образец крови и увидеть, есть ли у него рак, а по распределению связанных с раком ферментов можно было бы сказать, рак какого органа, вероятнее всего, развился у больного», – говорит Боссманн.
Хотя метод протестирован только на меланоме и на раке поджелудочной и молочной железы, Боссманн утверждает, что их технология применима для любой формы рака.
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России