Новые решения в проблеме адресной доставки лекарств
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Коллектив китайский ученых предложил использовать для адресной транспортировки лекарств к клеткам организма больного мезопористые шарики SiO2 (MS), к которым после химического модифицирования поверхности присоединялась молекула ДНК (aDNA). Поры MS заполнялись гостевыми молекулами, а для закрытия пор использовались наночастицы золота.
Проблема адресной доставки лекарств продолжает оставаться весьма насущной, что влечет за собой определенный интерес со стороны исследователей. При этом ученым необходимо решить две взаимосвязанные задачи – адресно доставить препарат на носителе и отделить препарат от носителя, причем последняя задача совсем не проще первой.
К настоящему времени большая часть носителей чувствительны к изменению температуры, рН или электромагнитному излучению. Однако куда более чувствительными являются так называемые биологические переключатели, например c применением молекул ДНК. В частности, коллектив китайский ученых предложил использовать для транспортировки мезопористые шарики SiO2 (MS), к которым после химического модифицирования поверхности (рис. 1) присоединялась молекула ДНК (aDNA).
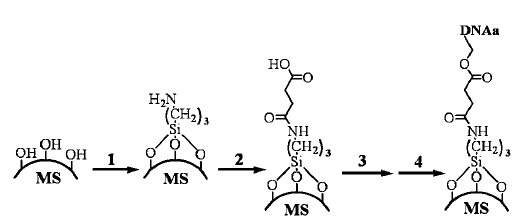 Рис. 1. Схематическое изображение химического модифицирования поверхности MS.
Рис. 1. Схематическое изображение химического модифицирования поверхности MS.
Затем, поры MS заполнялись гостевыми молекулами (в данном случае для наглядности люминесцирующим родамином B), в то время как поры закрывались наночастицами золота, к которым также пришита молекула ДНК (bDNA), комплементарная aDNA, что приводило к образованию двойной спирали. Так как bDNA была кодирована для распознавания определенного нуклеозида (в данном случае аденозина), то при встрече с ним происходила полная денатурация двойной спирали с высвобождением родамина B из пор.
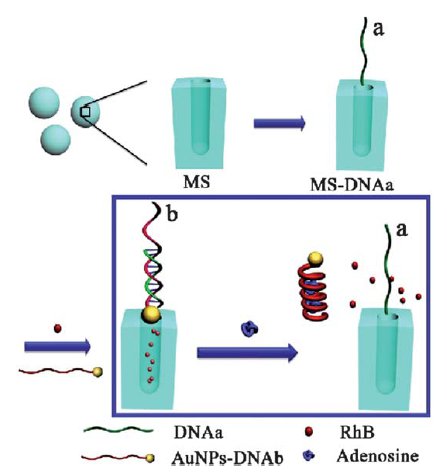 Рис. 2. Схематическое изображение процесса переноса.
Рис. 2. Схематическое изображение процесса переноса.
Для доказательства предложенного механизма (рис.2) авторы статьи модифицировали обе цепочки ДНК, «пришив» к одной из них люминофор (родамин зеленый), а к другой тушитель (dabcyl – 4-(4′- диметиламинофенилазо)бензойная кислота). После ренатурации из-за малого расстояния между тушителем и люминофором последний безызлучательно дезактивировался, в то время как после денатурации люминесценции родамина зеленого уже ничего не препятствовало (рис.3).
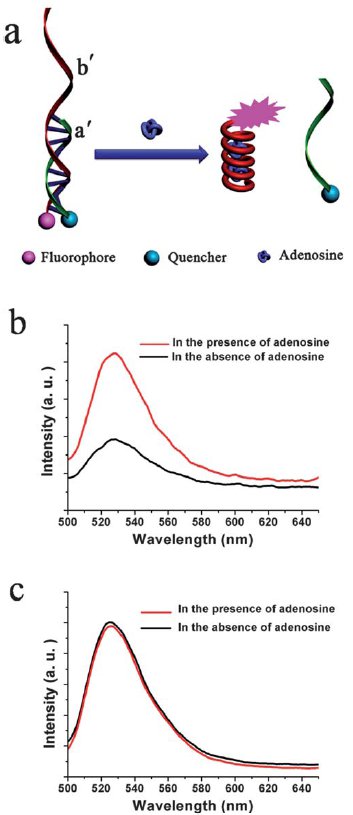 Рис. 3. а) денатурация двух «меченых» цепей ДНК b) спектры люминесценции «меченых» цепей ДНК в присутствии аденозина (красная кривая) и в его отсутствие (черная линия) с) спектры люминесценции «меченых» цепей ДНК, однако комплементарная цепь не кодирована на аденозин, поэтому интенсивность люминесценции не чувствительна к его присутствию.
Рис. 3. а) денатурация двух «меченых» цепей ДНК b) спектры люминесценции «меченых» цепей ДНК в присутствии аденозина (красная кривая) и в его отсутствие (черная линия) с) спектры люминесценции «меченых» цепей ДНК, однако комплементарная цепь не кодирована на аденозин, поэтому интенсивность люминесценции не чувствительна к его присутствию.
Результаты исследований изложены в статье:
Linfeng Chen, Yongqiang Wen, Bin Su, Jiancheng Di, Yanlin Song and Lei Jiang Programmable DNA switch for bioresponsive controlled release. – J. Mater. Chem. – 2011. – 21. – P.~13811–13816; DOI: 10.1039/C1JM12203G.
- Источник(и):
-
1. nanometer.ru
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России