Разработан более эффективный контрастный агент для диагностики рака
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Многие методы визуализации и контрастные агенты – химические вещества, используемые в процессе сканирования для обнаружения опухолей и других патологий – основаны на облучении или тяжелых металлах, что представляет потенциальную опасность для здоровья пациентов и ограничивает их применение. Чтобы устранить эти недостатки, инженеры из Университета Пенсильвании (University of Pennsylvania), США, разработали покрытие для контрастного агента – наночастиц оксида железа. Такой контраст взаимодействует только с кислой опухолевой средой, что делает его более эффективным, безопасным и дешевым, чем существующие альтернативы.
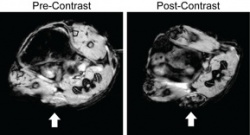 При использовании контрастного агента –
При использовании контрастного агента –
наночастиц с покрытием из гликольхитозана
– опухоль на МРТ-сканах (указана стрелкой)
становится темнее. (Фото: upenn.edu)
Магнитно-резонансная томография, или МРТ, становится все более распространенным методом медицинской диагностики. Используя сильное магнитное поле для обнаружения и влияние на молекулы воды в организме, МРТ может быстро создавать изображения широкого спектра тканей, хотя четкость этих изображений иногда недостаточна для уверенной диагностики. Для улучшения дифференциации – или контраста – между опухолевыми и здоровыми тканями врачи могут использовать контрастные вещества, например, наночастицы, содержащие оксид железа. Благодаря способности изменять магнитное поле сканера оксид железа может улучшить МРТ-изображения: области накопления магнитных наночастиц отображаются более четко.
Такие наночастицы, недавно одобренные в США для клинического применения в качестве контрастных агентов, покрыты молекулами сахаров; внешний декстрановый слой предотвращает слипание частиц или их поглощение тканями организма, потенциально защищая пациента от токсических побочных эффектов. Это инертное покрытие позволяет оксиду железу вымываться из организма после завершения процедуры, но оно исключает возможность ориентации наночастиц на конкретный вид ткани.
Контрастное вещество, способное взаимодействовать только с больной тканью, например, с опухолями, решило бы обе эти проблемы. Ученые уже опробовали такой подход, создав для наночастиц белковые покрытия, связывающиеся только с рецепторами на поверхности опухолей, но, к сожалению, с этой точки зрения опухоли отличаются завидным разнообразием.
Одним из ограничений рецепторного подхода является отсутствие универсальности. По словам руководителя проекта Эндрю Тсуркаса (Andrew Tsourkas), доцента кафедры биоинженерии Школы инженерии и прикладных наук (School of Engineering and Applied Science), трудно рекомендовать их в качестве скринингового инструмента, если известно, что рецепторы-мишени экспрессируются только 30 процентами опухолей.
Одним из преимуществ подхода, разрабатываемого группой Тсуркаса, является способность наночастиц попадать в подавляющее большинство опухолей, так как почти для всех видов злокачественных новообразований характерно изменение кислотности их микроокружения.
Чтобы решить проблему адресности наночастиц, ученые воспользовались эффектом Варбурга – известной особенностью опухолевого метаболизма. Большинство клеток организма аэробны, то есть получают энергию преимущественно при участии кислорода. Раковые же клетки используют для этого анаэробный процесс, даже при изобилии в среде кислорода. Подобно перегруженным мышцам, они превращают глюкозу в молочную кислоту, но, в отличие от здоровых мышц, с трудом «очищаются» от этой кислоты из-за нарушенного кровотока. Это означает, что раковые опухоли почти всегда имеют более низкие значения рН, чем окружающие их здоровые ткани.
Некоторые методы визуализации, такие как магнитно-резонансная спектроскопия, также используют преимущество низкой кислотности микроокружения опухоли, но они требуют дорогостоящего специализированного оборудования, которое, как правило, недоступно в клинических условиях.
Используя гликольхитозан – реагирующий на кислоты полимер на сахарной основе – ученые позволили наноносителям оставаться нейтральными вблизи здоровой ткани, но ионизироваться при низком показателе рН. Изменение заряда, происходящее в непосредственной близости от кислых опухолей, привлекает к ним наноносители и заставляет их оставаться в этих областях.
 (Рис. pubs.acs.org)
(Рис. pubs.acs.org)
Такой подход имеет еще одно преимущество: чем более злокачественна опухоль, тем больше она разрушает окружающие кровеносные сосуды и тем более кислой становится ее среда. Это означает, что покрытые гликольхитозаном наночастицы является хорошим детектором злокачественности, открывая возможности не только для диагностики, но и для лечения.
«Такое покрытие можно использовать для любых наночастиц, поэтому его возможности не ограничиваются только визуализацией», – говорит доктор Тсуркас. «Наночастицы с таким покрытием можно использовать и для доставки в опухоли лекарственных препаратов».
Ученые надеются, что в течение 7–10 лет покрытые гликольхитозаном наночастицы оксида железа смогут улучшить специфичность диагностического скрининга.
«Для МРТ-скрининга раковых опухолей молочной железы у пациентов с высокой степенью риска в качестве контрастного агента используется гадолиний. МРТ таким пациентам рекомендуется в дополнении к обычной маммографии, так как чувствительность маммографии может оказаться недостаточной», – объясняет Тсуркас. «Чувствительность МРТ гораздо выше, но ее специфичность низка: скрининг обнаруживает большое количество опухолей, но многие из них являются доброкачественными. Такой инструмент, как разработанный нами, позволит врачам лучше дифференцировать доброкачественные и злокачественные опухоли, тем более теперь, когда доказана корреляция между злокачественностью и рН».
Аннотация к статье
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России