Как белковые сети стабилизируют мышечные волокна, или метилирование за пределами клеточного ядра
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Метилирование, стабилизирующее ДНК в ядре клетки, важно и для структуры и функции клеток мышечной ткани позвоночных. Это установлено профессором доктором Вольфгангом Линке (Wolfgang Linke) из Института физиологии (Institute of Physiology) Рурского университета в Бохуме (Ruhr-Universität Bochum), ФРГ, в сотрудничестве с американскими и немецкими коллегами. Один из ферментов присоединяет метильную группу к белку Hsp90, который затем образует комплекс с мышечным белком титином. При разрушении этой белковой сети мышечная структура частично распадается. Таким образом, метилирование играет значительную роль и за пределами клеточного ядра.
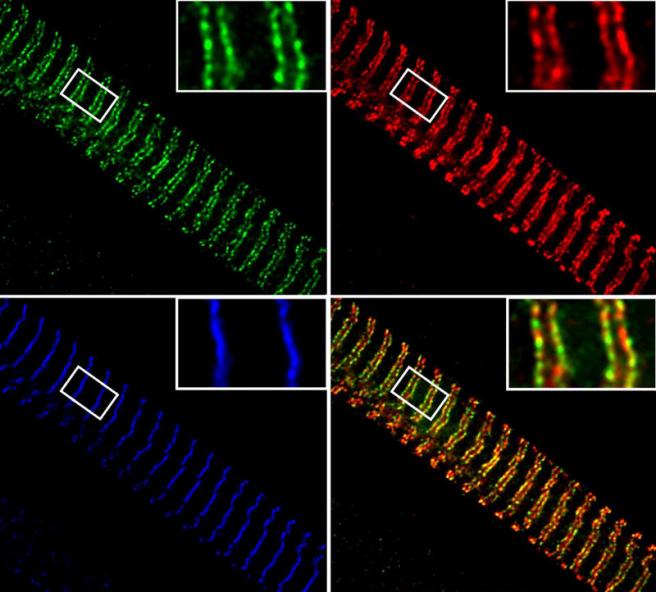 Белковые комплексы в мышечной клетке. Миофибриллы – строительные блоки клеток мышц с регулярными поперечно-полосатыми структурами (показаны синим).
Белковые комплексы в мышечной клетке. Миофибриллы – строительные блоки клеток мышц с регулярными поперечно-полосатыми структурами (показаны синим).
Мышечные клетки эластичны благодаря присутствию в миофибриллах гигантского белка титина (красный). Метилированный белок теплового шока Hsp90 связывается вместе
с метилтрансферазой Smyd2 (зеленая) с упругими титиновыми пружинами и стабилизирует их. Снизу справа показана колокализация фермента Smyd2 и эластичной области титина.
(Илл. Prof. Wolfgang A. Linke).
Метильные (СН3) группы к определенным участкам ДНК в ядре клетки переносят ферменты метилтрансферазы. Цель переноса метильной группы – маркировка активных и неактивных участков генов. Однако не только ДНК, но и ядерные белки могут нести метильную метку, как правило, у аминокислоты лизина. Метилированные лизиновые остатки ядерных белков способствуют образованию белковых комплексов, которые контролируют, например, репарацию или репликацию ДНК. Но ферменты метилтрансферазы находятся не только в ядре, но и цитоплазме клетки. Однако, какие белки они метилируют и как это метилирование влияет на их функции, изучено недостаточно.
Профессор Линке и его коллеги начали свои эксперименты с идентификации фермента (Smyd2), в основном присутствующего в цитоплазме, который метилирует аминокислоту лизин, а затем приступили к поиску взаимодействующих с ним партнеров и обнаружили белок теплового шока Hsp90. Не остановившись на достигнутом, они доказали, что Smyd2 и метилированный Hsp90 образуют комплекс с мышечным белком титином (titin).
«Титин – самый большой белок человеческого организма и известен, в первую очередь, тем, что в мышечных клетках он выступает в роли упругой пружины», – объясняет профессор Линке. «Именно эта упругая область титина защищена ассоциацией с метилированным Hsp90».
Что происходит, если защита метилированными белками теплового шока подавляется, исследователи изучили на клетках скелетных мышц рыбки-зебры (данио рерио). С помощью генетических манипуляций они подавили выработку фермент Smyd2 в организме рыбки, что блокировало метилирование Hsp90. Отсутствие метилированных Hsp90 привело к потере стабильности упругой области титина и серьезному нарушению функции мышц и их нормальной структуры.
Результаты исследования опубликованы в журнале Genes and Development.
Аннотация к статье
Smyd2 controls cytoplasmic lysine methylation of Hsp90 and myofilament organization
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России