Плазмонные нанопузырьки одновременно убивают раковые и модифицируют другие клетки
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Исследователи из Университета Райса (Rice University) нашли способ разрушать больные и лечить другие клетки, находящиеся в одном и том же образце. В основе нового метода лежит воздействие одним лазерным импульсом на полые и солидные наночастицы золота.
 Профессор Дмитрий Лапотко и его коллеги – Екатерина
Профессор Дмитрий Лапотко и его коллеги – Екатерина
Лукьянова-Хлеб и Мартин Мутонга (Martin Mutonga).
(Фото: Jeff Fitlow/Rice University)
Уникальный метод настраиваемых плазмонных нанопузырьков, разработанный в лаборатории профессора Дмитрия Лапотко (Dmitri Lapotko), представляет собой перспективную – быструю, простую и многофункциональную – альтернативу нескольким сложным процессам, используемым в настоящее время для лечения, в частности, онкологических больных.
Плазмонные нанопузырьки, размером в 10000 раз меньше толщины человеческого волоса, образуются вокруг плазмонных наночастиц золота, которые нагреваются при возбуждении внешним источником энергии – в данном случае коротким лазерным импульсом – и испаряют тонкий слой жидкости вблизи поверхности частицы. Пузырек пара быстро растет и лопается. Ранее Лапотко и его коллеги уже доказали, что плазмонные нанопузырьки убивают раковые клетки, буквально взрывая их, и не наносят при этом вреда здоровым соседям. Этот процесс гораздо более точен и селективен, чем разрушение раковых клеток только наночастицами золота.
В новом проекте ученые продвинулись далеко вперед. В серии экспериментов, результаты которых опубликованы в журнале ACS Nano, издании Американского химического общества (American Chemical Society), было доказано, что вокруг полых наносфер один лазерный импульс создает большие плазмонные нанопузырьки, селективно разрушающие нежелательные клетки. Вокруг солидных наночастиц золота этот же лазерный импульс создает нанопузырьки меньшего размера, которые способны лишь пробивать мельчайшие короткоживущие поры во внешних мембранах клеток и создавать входящие «наноструи», которые быстро «инъецируют» лекарственные препараты или гены в другие клетки.
В своих экспериментах Лапотко и его группа ввели полые нанооболочки размером 60 нанометров в модельные клетки рака и окрасили эти клетки в красный цвет. В другую партию клеток того же типа они ввели 60-нанометровые солидные наносферы и окрасили клетки в синий цвет.
Смешав оба набора клеток с зеленым флуоресцентным красителем, ученые обработали этот образец одним лазерным импульсом, а затем вымыли из него зеленый краситель и исследовали клетки под микроскопом. Красные клетки с полыми нанооболочками были разрушены большими плазмонными нанопузырьками. Синие клетки остались невредимы, но в них попала зеленая жидкость извне, так как более мелкие плазмонные нанопузырьки, образовавшиеся вокруг наносфер, пробили временные поры в их стенках.
Так как все это происходит за доли секунды, такая система позволяет селективно обрабатывать 10 миллиардов клеток в минуту и значительно усовершенствовать технологии клеточной и генной терапии и методы трансплантации костного мозга.
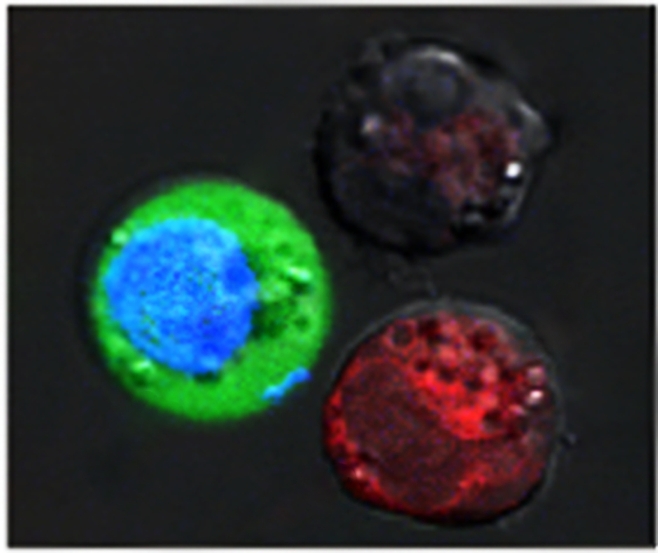 Идентичные клетки, окрашенных в красный и синий цвет, стали объектом исследования ученых Университета Райса, доказывающего эффект плазмонных
Идентичные клетки, окрашенных в красный и синий цвет, стали объектом исследования ученых Университета Райса, доказывающего эффект плазмонных
нанопузырьков. Пузырьки образуются вокруг нагретых наночастиц золота, мишенью которых являются определенные, например, раковые клетки. Вокруг полых наночастиц
образуются пузырьки достаточно большие, чтобы взрывы этих пузырьков могли уничтожить клетки. Вокруг солидных частиц образуются пузырьки меньшего размера,
но они пробивают временные поры в клеточной мембране, через которые в клетки могут поступать лекарственные препараты и другие агенты. Оба эффекта
достигаются одновременно одним лазерным импульсом. На снимке: окрашенная красным клетка с признаками разрушения взрывами нанопузырьков и
оставшаяся неповрежденной клетка, окрашенная синим, с поступившим в нее зеленым флуоресцентным красителем. (Plasmonic Nanobubble Lab/Rice University)
Большинство методов генной терапии предусматривает воздействие на клетки вне организма больного. Например, чтобы устранить нежелательные (в частности, раковые) клетки и, с целью повышения их терапевтической эффективности, генетически модифицировать другие клетки, необходима обработка человеческих трансплантатов.
«Сегодняшние методы обработки, с большой потерей клеток и низкой селективностью, медленны, дороги и трудоемки. В идеале и устранение нежелательных клеток, и трансфекция (введение в клетку генетического материала) должны быть высокоэффективными, селективными, быстрыми и безопасными», – считает профессор Лапотко.
По мнению сотрудничающего с группой Лапотко Малькольма Бреннера (Malcolm Brenner), профессора медицины и педиатрии Медицинского колледжа Бейлора (Baylor College of Medicine) и директора Центра клеточной и генной терапии (Center for Cell and Gene Therapy) BCM, технология плазмонных нанопузырьков обещает «метод, одновременно по-разному воздействующий на клеточную популяцию».
«Например, если я хочу внедрить что-то в стволовую клетку, чтобы заставить ее превратиться в клетку другого типа, и в то же самое время убить окружающие клетки, которые при возвращении в организм этого или другого пациента могут причинить вред, тонко настраиваемые плазмонные нанопузырьки могут все это сделать», – комментирует технологию профессор Бреннер.
По словам Лапотко, в долгосрочной перспективе цель сотрудничества Университета Райса, Медицинского колледжа Бейлора, Техасской детской больницы (Texas Children's Hospital) и Онкологического центра Андерсона (University of Texas MD Anderson Cancer Center) – улучшить результаты терапии пациентов с заболеваниями, лечение которых требует воздействия на клетки вне организма больного.
Дмитрий Лапотко планирует создать пилотный метод с перспективой тестирования на человеческих клетках в ближайшем будущем.
«Мы хотели бы, чтобы он стал универсальной платформой для клеточной и генной терапии и трансплантации стволовых клеток», – говорит ученый.
Работа финансировалась Национальными институтами здравоохранения (National Institutes of Health) США.
Аннотация к статье
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России