Катализатор поможет химикам превратить природные аминокислоты в искусственные
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Химики из Университета Иллинойса и исследовательского центра Pfizer разработали катализатор, способный направленно модифицировать определенный участок трех природных аминокислот — пролина, валина, лейцина. Интересно, что специфичности катализатора оказывается достаточно, чтобы модифицировать аминокислоты в составе олигопептидов (коротких белковых молекул). Исследование опубликовано в журнале Nature, кратко о нем сообщает пресс-релиз университета.
Модификация природных аминокислот — процесс происходящий в нашем организме под действием специальных ферментов. Одним из самых распространенных путей модификации является окисление одного из атомов углерода в молекуле аминокислоты. При этом связь углерод-водород превращается в связь углерод-гидроксогруппа (-OH). К примеру, такой процесс лежит в основе биосинтеза ванкомицина — известного антибиотика.
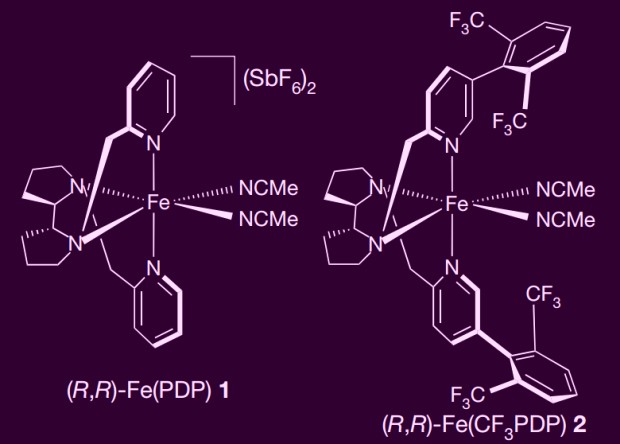 Строение катализаторов селективного окисления аминокислот. Thomas J. Osberger et al. / Nature, 2016
Строение катализаторов селективного окисления аминокислот. Thomas J. Osberger et al. / Nature, 2016
Направленное окисление аминокислот идет в нашем организме с помощью специальных катализаторов — белков-ферментов, которые, как правило, содержат в себе атом железа. Однако каждый фермент обладает узкой специализацией — он действует только на одну аминокислоту, или, более того, на одну аминокислоту в определенном белке.
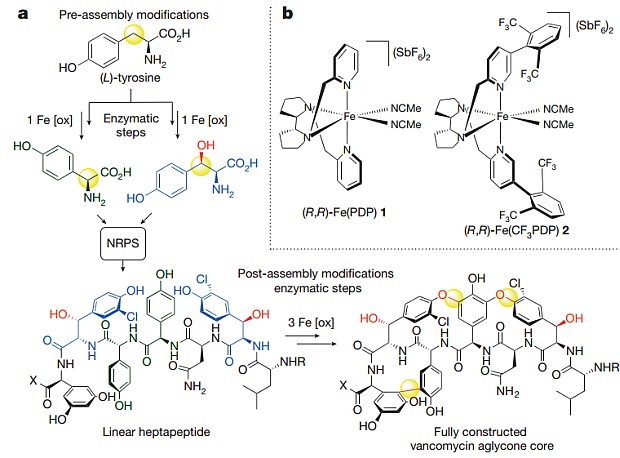 Биосинтез ванкомицина (a). На врезе — структура катализаторов для селективного окисления пролина, валина и лейцина. Thomas J. Osberger et al. / Nature, 2016
Биосинтез ванкомицина (a). На врезе — структура катализаторов для селективного окисления пролина, валина и лейцина. Thomas J. Osberger et al. / Nature, 2016
Окисление аминокислот — эффективный путь для создания новых искусственных молекул, используемых, например, в синтезе лекарственных препаратов. Для того, чтобы получить несколько исходных окисленных аминокислот для последующих химических превращений, потребуется соответствующее количество ферментов. Новая работа позволяет сократить этот набор до одного-двух катализаторов.
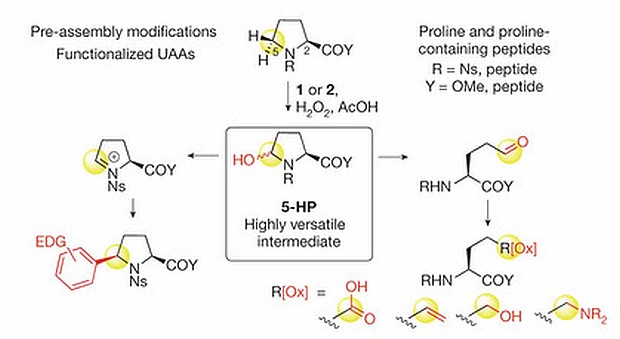 Схема возможных превращений пролина после окисления перекисью водорода в присутствие железосодержащего катализатора. Thomas J. Osberger et al. / Nature, 2016
Схема возможных превращений пролина после окисления перекисью водорода в присутствие железосодержащего катализатора. Thomas J. Osberger et al. / Nature, 2016
Химики предложили заменить сложные белковые катализаторы на низкомолекулярные (небольшие) комплексы железа. Первые эксперименты позволили получить 21 искусственную аминокислоту на основе трех природных и одной искусственной — пролина, валина, норвалина и лейцина. Кроме того, авторы проверили специфичность катализатора на ди- и трипептидах (молекулах, состоящих из двух и трех аминокислотных фрагментов соответственно) — воздействию всегда подвергался строго один и тот же атом углерода в структуре молекулы.
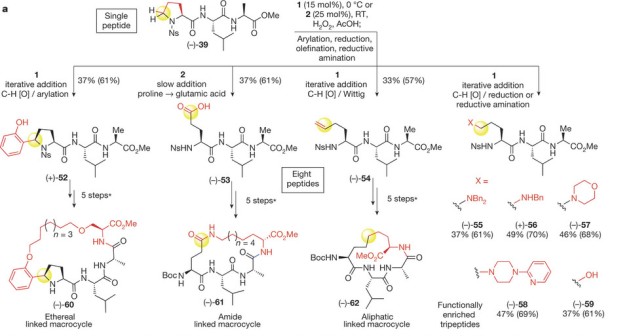 Схема превращения трипептида на основе природных аминокислот в восемь трипептидов, содержащих остатки искусственных аминокислот. Thomas J. Osberger et al. / Nature, 2016
Схема превращения трипептида на основе природных аминокислот в восемь трипептидов, содержащих остатки искусственных аминокислот. Thomas J. Osberger et al. / Nature, 2016
В частности, химикам удалось с помощью каталитического окисления превратить один трипептид в восемь разных трипептидов, содержащих искусственные аминокислоты. По словам авторов, классические подходы потребовали бы восемь различных синтезов «с нуля».
Традиционно под аминокислотами понимают органические молекулы, содержащие аминогруппу (-NH2) и остаток карбоновой кислоты (-COOH) у одного атома углерода (α-аминокислоты). Термин природные аминокислоты относится к 20 таким соединениям, кодируемым триплетами ДНК — все они входят в состав белков, синтезируемых организмами. В белках встречаются и другие аминокислоты, но их число гораздо меньше.
Ученые используют искусственные аминокислоты для того, чтобы синтезировать новые вещества и белки. Например, с их помощью можно добиваться возникновения у белков новых свойств. Кроме того, искусственные аминокислоты входят в состав различных препаратов, обладая фармакологической активностью. К этой категории относятся ингибиторы АПФ, такие как эналаприл и каптоприл.
Автор: Владимир Королёв
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России