Паутину превратили в молекулярный динамометр
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Американские биоинженеры разработали новый вид «молекулярного динамометра» из пептидной пружины на основе одного из белка пауков. Такой молекулярный прибор позволяет измерять механическое натяжение прямо внутри живой клетки, причем для этого достаточно просто наблюдать в микроскоп за характером свечения флюоресцентных белков. Описание работы опубликовано в журнале NanoLetters.
Динамометр устроен следующим образом. Он состоит из двух флюоресцентных белков, которые участвуют в резонансном переносе энергии(FRET) и при этом разделены пептидной пружиной. Входе резонансного переноса возбуждение c одного из белков (донора) переносится на другой (акцептор) за счет взаимодействия их светящихся частей, хромофоров. Это взаимодействие, однако, сильно падает с увеличением расстояния между донором и акцептором (оно пропорционально шестой степени расстояния). Поэтому, если два белка находятся очень близко друг к другу,преимущественно светится белок-акцептор.Если же расстояние между ними становится большѝм, светится белок-донор. Так как длины волн испускаемого свечения у белков отличаются,то наблюдая за спектром флюоресценции можно измерять расстояние между ними.
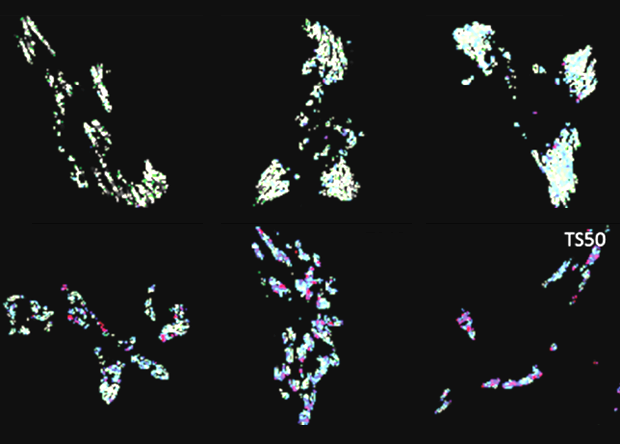 Флуоресценция клеток с белками цитоскелета, помеченными молекулярными динамометрами. Внизу — экспериметр, вверху — белки, лишенные места прикрепления и оттого не несущие механического напряжения. Michael D. Brenner et al., 2016, Nanoletters
Флуоресценция клеток с белками цитоскелета, помеченными молекулярными динамометрами. Внизу — экспериметр, вверху — белки, лишенные места прикрепления и оттого не несущие механического напряжения. Michael D. Brenner et al., 2016, Nanoletters
Технология FRET уже довольно давно применяется в биологии для исследования белок-белковых взаимодействий, однако авторы новой работы решили пойти дальше и создали на основе резонансного переноса флюоресценции молекулярный динамометр.Для этого ученым понадобилась пружина,которая бы соединяла два белка и могла растягиваться при приложении внешней силы. Для создания такой пружины важно,чтобы степень растяжения была прямо пропорциональна величине приложенной силы (чтобы деформация была упругой). Обычные белки такой линейностью не обладают: они сначала жестко сопротивляются растяжению, а затем полностью теряют структуру и разрушаются.
Чтобы решить эту проблему ученые обратились к эластичным белкам паучьего шелка. Ранее авторы испытали пружины, созданные из восьми повторов аминокислот GPGGA, которые входят в состав белка флагеллиформа. В новой работе ученые создали набор новых пружин различной длины и измерили зависимость их растяжения от величины приложенного напряжения.
Оказалось,что самые короткие пружины обладают самой большой относительной растяжимостью:они способны увеличиваться в пять разне теряя при этом линейной упругости.Молекулярные динамометры, созданные на их основе, оказались способны измерять силу в диапазоне от 2 до 11 пиконьютонов (10–12ньютонов). Для сравнения, один пиконьютон приблизительно равен весу одной бактерии.
Поскольку пружины сделаны из пептидов, а неискусственных материалов, их легков вести в генетические конструкции и синтезировать прямо в клетках. Авторы продемонстрировали удобство новой технологии, введя динамометры в состав белка цитоскелета виментина и проследив за тем, как он натягивается при образовании клеточных контактов (виментин соединяет нити актина с белками, закрепленными на клеточных мембранах).
Автор: Александр Ершов
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России