Роборуку для пэтч-клампа научили мытью микропипеток
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Американские ученые создали робота для локальной фиксации потенциала и очищения микропипеток между пробами. Результаты работы опубликованы в журнале Nature Communications.
Метод локальной фиксации потенциала (patch-clamp) — методика для изучения ионных каналов в мембране клеток, впервые была описана в 1981 году. Один из вариантов метода заключается в следующем. В специальную установку помещается микропипетка с электродом, наконечник которой «присасывается» к мембране клетки. В результате изоляции на границе мембраны образуется гигасил — электрическое сопротивление более гигаома, — что позволяет локально регистрировать и контролировать ионные токи между сторонами мембраны. Таким образом изучаются реакции отдельных клеток на электрическое или химическое воздействие.
По словам авторов, несмотря на длительную историю и относительную простоту метод по-прежнему требует активных действий со стороны оператора. После каждой пробы в микропипетке остаются фрагменты мембраны, но поскольку нет механизма, который бы ее очищал, она заменяется на новую — также вручную. Это значительно замедляет процесс.
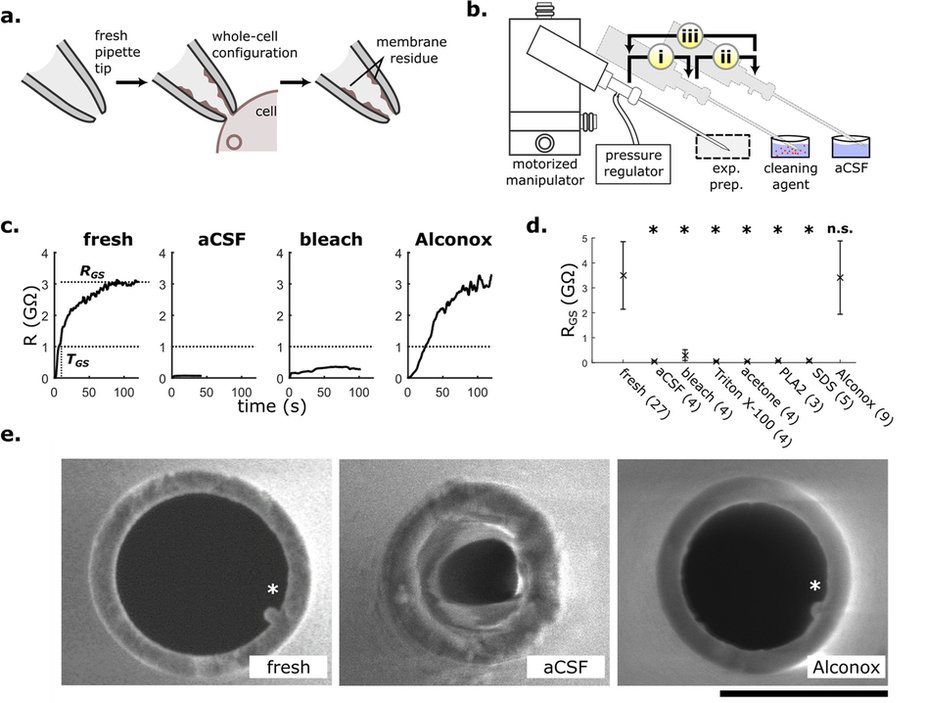 Сравнение уровней сопротивления и загрязнения микропипетки при разных способах очистки (aCSF использовалась изолированно) / © I. Kolb et al., Nature Communications
Сравнение уровней сопротивления и загрязнения микропипетки при разных способах очистки (aCSF использовалась изолированно) / © I. Kolb et al., Nature Communications
Ученые из Технологического института Джорджии усовершенствовали метод. По заказу они изготовили систему контроля давления, перепрограммировали стандартные микроманипуляторы и спроектировали графический интерфейс для управления установкой с компьютера. Сам механизм был дополнен двумя ванночками — с моющим средством для лабораторной посуды (Alconox) и с искусственной спинномозговой жидкостью (aCSF). После регистрации токов робот захватывает микропипеткой очиститель (3 нанолитра), через 10 секунд жидкость выталкивается под давлением 1000 микробар и микропипетка наполняется aCSF. Спустя еще 10 секунд выталкивается aCSF, и стерилизованная микропипетка возвращается в исходное положение. Вся процедура очистки занимает около одной минуты.
Система тестировалась на клетках эмбриональных почек человека (HEK293T). В полуавтоматическом режиме авторам удалось изучить участки 84 клеток с помощью восьми микропипеток при точности измерений 95 процентов. При однократной неудачной попытке изоляции мембраны микропипетка очищалась и снова использовалась без ущерба для качества. Ученые подчеркнули, что не проверяли работоспособность микропипеток после десяти использований. Предполагается, что после 26 повторных проб и трех последовательных неудач они приходят в негодность.
Кроме того, авторы испытали установку на нейронах живой мыши. С помощью четырех пипеток они сделали 10 успешных замеров (в этом случае измерялась разность потенциалов целых клеток) из 34, в 13 пробах был достигнут нужный уровень сопротивления. Общая продолжительность эксперимента составила 171 минуту.
«Это шаг к революционным роботизированным технологиям в области нейробиологии. Мы бы хотели оставлять образцы в нашей установке и уходить, пока машина делает пробы 50 или 100 нейронов. Такой вид автоматизации уже доступен, например, в молекулярной биологии, и он значительно расширяет возможности для изучения мозга», — сообщил соавтор работы Крэйг Форест (Craig Forest).
 Тестирование робота на живой мыши / © I. Kolb et al., Nature Communications
Тестирование робота на живой мыши / © I. Kolb et al., Nature Communications
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России