Специальная теория относительности помогла «выжить» аниону платины
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Химики из лаборатории Эймса и Университета Айовы впервые синтезировали двойную соль, содержащую двухзарядную платину в качестве отрицательного иона — Cs9Pt4H. Ранее были известны лишь два соединения с похожими свойствами. За устойчивость такого необычного состояния платины отвечают эффекты, предсказанные специальной теорией относительности. Они связаны с большой (сопоставимой со скоростью света) скоростью электронов на внешней оболочке металла. Исследование опубликовано в журнале Angewandte Chemie International Edition, кратко о нем сообщает Chemistry World.
Металлы характеризуются тем, что они легко отдают электроны в химических реакциях, причем чем меньше для этого надо затратить энергии, тем более выражены металлические свойства. Самым «типичным» металлом в этом смысле является цезий. Напротив, неметаллы характеризуются своей способностью принимать электроны — сродством к электронам. Самый «типичный» неметалл — это фтор, который способен «отобрать» электроны даже у кислорода.
С этими свойствами связано распределение электронов между парой атомов, образующих химическую связь. В подавляющем большинстве случаев на атоме металла оказывается недостаток электронов, а на атоме неметалла — избыток. В некоторых случаях, когда связь образуется между элементом с выраженными металлическими свойствами и неметаллом, внешние электроны покидают металл и переходят на неметалл. При этом образуется положительно и отрицательно заряженные частицы — катион металла и анион неметалла, а такая связь называется ионной.
 Кристаллы платинида цезия (слева) и гидрида-платинида цезия (справа). Volodymyr Smetana et al. / Angew. Chem. Int. Ed, 2016
Кристаллы платинида цезия (слева) и гидрида-платинида цезия (справа). Volodymyr Smetana et al. / Angew. Chem. Int. Ed, 2016
Благодаря таким свойствам атомы металлов крайне редко оказываются отрицательно заряжены в химических соединениях. Кроме того, как правило, с ростом атомного номера в столбце таблицы Менделеева металлические свойства проявляются все сильнее: оторвать внешний электрон становится все легче, так как он оказывается все дальше от ядра. Поэтому натрий (11-й элемент) «металличнее» лития (3-го), а иод (53-й элемент) «металличнее» брома (35-го).
Серьезные отклонения от этой тенденции наблюдаются у тяжелых элементов, находящихся в шестом периоде таблицы Менделеева. Они связаны с тем, что большой заряд ядра и одновременная удаленность электронов от него (на внешних оболочках) заставляет последних двигаться с околосветовыми скоростями. Это движение требует учета специальной теории относительности и внесения релятивистских поправок в наблюдаемую массу частиц. Вместе с изменением массы меняются и энергетические свойства орбитали (она оказывается ближе к ядру, чем можно ожидать без учета поправок). Эти изменения сказываются на физических и химических свойствах элементов.
Из стабильных элементов сильнее всего эти изменения выражены у золота, платины и ртути. К примеру, сродство к электрону у золота оказывается примерно того же порядка, что и у галогенов иода и астата (для брома, хлора и фтора эта величина значительно выше, чем у золота). Это проявляется в том, что с металлами, способными легко отдавать электроны, золото способно давать ионные соединения. В 1938 году химики синтезировали сплавлением двух металлов аурид цезия (CsAu, структура была подтверждена в 1943 году), обладавший ионным характером. Золото несло в нем отрицательный заряд, а цезий — положительный. В отличие от обычных сплавов металлов, это вещество представляло собой прозрачные желтые кристаллы. Позднее аналогичные ауриды были получены для рубидия и калия.
 Раствор аурида цезия в жидком аммиаке (слева) и кристаллическая форма вещества (справа). Желтое — аурид цезия, темно-синее — его комплекс с аммиаком. A.-V. Mudring et al., Rheinische Friedrich-Wilhelms-Universität, Bonn, 2001
Раствор аурида цезия в жидком аммиаке (слева) и кристаллическая форма вещества (справа). Желтое — аурид цезия, темно-синее — его комплекс с аммиаком. A.-V. Mudring et al., Rheinische Friedrich-Wilhelms-Universität, Bonn, 2001
В случае платины сродство к электрону оказывается даже выше, чем у всех двухзарядных аналогов — серы, селена и теллура. Однако первый платинид был получен лишь в 2003 году. Им стало соединение состава Cs2Pt. Как и в случае аурида цезия, оно обладало желтой окраской и было прозрачным. Отсутствие металлического блеска связано с тем, что платинид полностью лишен свободных электронов. По своему строению он является более тяжелым родственником теллуридов и селенидов цезия. Позднее было получено еще одно соединение этого класса — платинид бария.
В новой работе химики предприняли попытку получить более сложное соединение двухзарядного аниона платины — двойную соль. Такие вещества содержат в своем составе два различных катиона или аниона — одним из самых известных примеров являются квасцы. Аналогичные соединения были известны для золота. Для синтеза химики смешали в танталовых ампулах гидрид цезия, платину и металлический цезий и продержали при температуре в 200–400 градусов Цельсия несколько дней. В результате в ампулах образовались прозрачные красные кристаллы, состав которых отвечал формуле Cs9Pt4H. С точки зрения свойств, они соответствуют двойной соли гидрида и платинида цезия 4Cs2Pt·CsH.
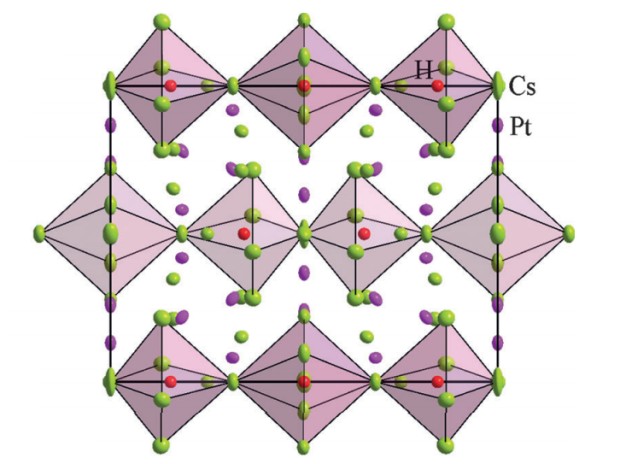 Кристаллическая структура гидрида-платинида цезия. Volodymyr Smetana et al. / Angew. Chem. Int. Ed, 2016
Кристаллическая структура гидрида-платинида цезия. Volodymyr Smetana et al. / Angew. Chem. Int. Ed, 2016
Стабильность аниона платины в соединении полностью определяется релятивистскими эффектами. В частице Pt2- оказывается полностью заполнена внешняя орбиталь (сферическая 6s). Поправки из скорости электронов «сжимают» ее, делая выгодным заполненное состояние, по аналогии с полностью заполненными орбиталями благородных газов.
Интересно, что цезий, платина и водород образуют еще целый ряд гидридов различного состава: Cs2PtD4, Cs2PtD6 (описаны дейтериевые производные). Но во всех них платина несет на себе положительный заряд.
Релятивистские эффекты проявляются в химии и более очевидным образом. К примеру, с их помощью объясняются цвета металлического золота и цезия (оба — желтоватые). Сжатие внешней орбитали у ртути ослабляет связь между соседними атомами — с этим связывают то, что она жидкая при комнатной температуре, в отличие от своих соседей по таблице Менделеева. В газовой фазе одиночные атомы ртути в некотором смысле аналогичны благородным газам, словно бы имея полностью заполненную электронную оболочку.
Грубо оценить вклад релятивистских эффектов можно, определив скорость движения электрона по формуле ve=Z×с/137, где Z — заряд ядра (или порядковый номер в таблице Менделеева), а с — скорость света. Для золота, палладия и ртути этот расчет дает скорость чуть выше 50 процентов скорости света. Соответствующий прирост наблюдаемой массы электрона достигает 20 процентов.**
Автор: Владимир Королёв
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России