Бактерий заставили писать отчеты о работе с помощью CRISPR
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Ученые придумали, как использовать систему CRISPR-Cas для того, чтобы заставлять клетки последовательно записывать в собственный геном «историю» биологических сигналов. Это позволит отслеживать, например, изменения в метаболизме и уровне экспрессии генов, а также различать клеточные линии по характеру проходящих в них биохимических процессов. Исследование опубликовано в журнале Science.
Система CRISPR-Cas широко используется сейчас для геномного редактирования , но в природе она нужна бактериям, в частности, для того, чтобы бороться с чужеродным (например, вирусным) генетическим материалом. Система обладает способностью «вписывать» в собственный геном кусочки чужеродной ДНК, чтобы затем, пользуясь этими записями, как шаблонами, находить такую ДНК в цитоплазме и разрезать ее, борясь таким образом с патогенами. Участки-шаблоны называются «спейсерами», и располагаются они в строго очередном порядке — новые спейсеры всегда добавляются в CRISPR-кассету в геноме с одного и того же конца.
Ученые воспользовались этой особенностью CRISPR-системы и разработали технологию, которую назвали TRACE (от английского слова «отслеживать»; аббревиатура расшифровывается как «Temporal Recording in Arrays by CRISPR Expansion»). Технология основана на следующем принципе: небольшие участки ДНК, которые называются триггерными спейсерами, «записываются» в CRISPR-кассету под воздействием определенных сигналов, а когда сигналов нет, вместо этого туда записываются обычные, «референсные» спейсеры в привычном для клетке темпе. После этого, прочтя кассету, можно детектировать, когда и какой именно спейсер в нее встроился, и понять таким образом, какие изменения происходили в клетке с течением времени.
 Концептуальное изображение системы записи TRACE CRISPR. Ravi Sheth
Концептуальное изображение системы записи TRACE CRISPR. Ravi Sheth
Триггерные спейсеры появляются в клетке за счет специальных искусственных плазмид (кольцевых молекул ДНК, несущих несколько генов, которые могут самостоятельно реплицироваться). Они были сконструированы таким образом, что при повышении уровня заданной сигнальной молекулы (изначально это был ИПТГ, изопропил-β-D-1-тиогалактопиранозид) в среде у них повышалась экспрессия белка, ответственного за репликацию плазмиды, что, в свою очередь, существенно увеличивало количество плазмид этого типа в клетке. Убедившись, что эта система работает, ученые также сделали другие плазмиды, с генами, кодирующими белки Cas1 и Cas2. Эти белки ответственны за встраивание новых спейсеров в CRISPR. Экспрессия этих генов также контролировалась с помощью определенных сигнальных молекул (ангидротетрациклина). Включение экспрессии генов второго типа плазмид (то есть синтез Cas1 и Cas2) обуславливало успешное встраивание в CRISPR-кассеты значимого количество спейсеров из плазмид первого типа, которых в клетке при активации ИПТГ становилось очень много.
Спейсеры встраивались в кассеты с разной скоростью, и для учета этих различий ученые создали аналитическую модель, позволяющей рассчитать вероятность встраивания тех или иных спейсеров в определенные позиции при возникновении или отсутствии сигнала. Протестировав технологию на кишечных палочках (Escherichia coli), они убедились, что система TRACE позволяет успешно отслеживать добавление и исключение ИПТГ во времени. После этого они расширили эксперимент, заставив систему в трех разных типах клеток реагировать на три разные типа биологических сигналов в течение трех дней. В качестве сигналов использовали медь, трегалозу и фукозу, которые появлялись в среде в разное время в разном порядке. Система буквально записывала соответствующую последовательность в CRISPR и потом эту запись можно было прочесть с помощью секвенирования и расшифровать, пользуясь аналитической моделью.
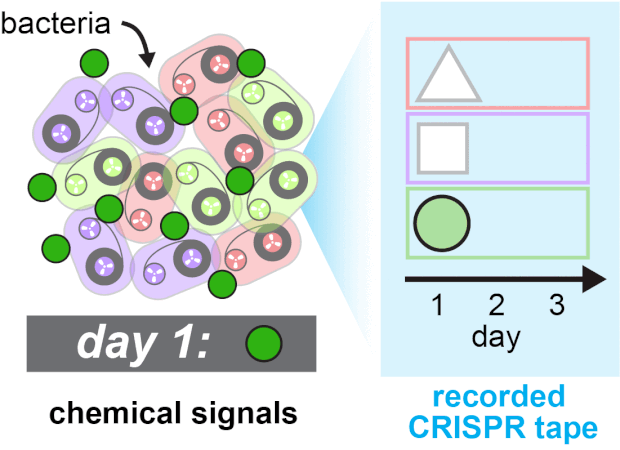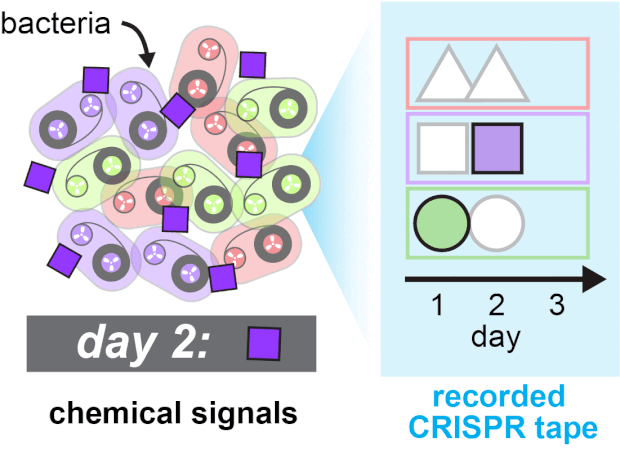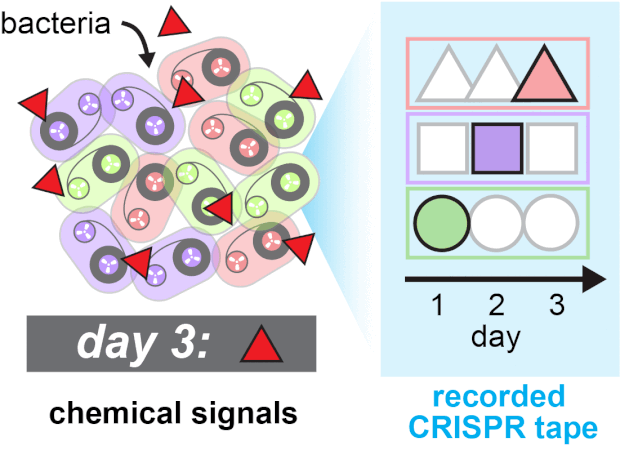 Последовательная запись трех типов сигналов. Ravi U. Sheth et al / Science, 2017
Последовательная запись трех типов сигналов. Ravi U. Sheth et al / Science, 2017
Ученые считают, что новая система, последовательно записывающая происходящее в клетке, может быть использована для временной оценки изменения экспрессии генов и метаболических процессов, в том числе в средах, в которых неудобно отслеживать эти процессы иным образом — например, в микробиомах кишечника животных или в морских сообществах бактерий. Скорость записи можно будет также редактировать с помощью изменения работы белков Cas — ученые собираются далее совершенствовать систему, делая ее более точной и чувствительной. Добившись определенной степени чувствительности, можно будет записывать изменения даже внутри отдельных клеток, полагают они.
А о редактировании всех точечных мутаций с помощью CRIPSR, но без разрезания двойной цепи ДНК, вы можете прочитать здесь.
Автор: Анна Казнадзей
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России