Физики измерили любовь к электронам у отдельных атомов
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Физики из Австрии и Австралии впервые напрямую измерили электроотрицательность отдельных атомов. Для этого исследователи использовали атомно-силовой микроскоп, с помощью которого измеряли взаимодействие между атомом на конце его иглы и атомом на поверхности образца. По словам ученых, результаты совпали с теоретическими предсказаниями, вычисленными еще Лайнусом Полингом в 1930-х годах. Исследование опубликовано в журнале Nature Communications, кратко о нем сообщает Chemistry World.
Электроотрицательность атома — количественная характеристика, которая показывает насколько сильно атом в связи стягивает к себе электронную плотность. К примеру, если взять два атома, у одного из которых электроотрицательность будет очень высокой (фтор), а у другого — очень низкой (цезий), то окажется, что электроны, образующие связь между этими атомами, полностью «перетянутся» к наиболее электроотрицательному атому. Связь станет ионной. Если наоборот взять два атома с одинаковой электроотрицательностью (два атома фтора или два атома водорода), то электронная плотность связи между ними будет распределена симметрично.
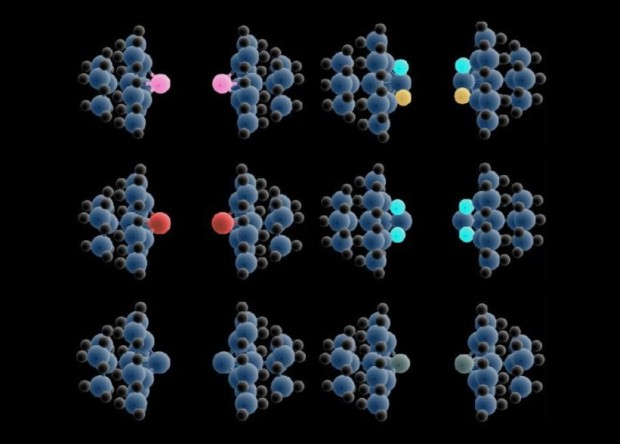 Схемы взаимодействия между двумя атомами, использовавшиеся в квантово-химических расчетах. Из этой расчетной энергии, энергии взаимодействия иглы с кремниевой поверхностью и с поверхностным атомом кислорода можно определить разность в электроотрицательности данного атома кислорода и кремния. Jo Onoda et al. / Nature Communications, 2017
Схемы взаимодействия между двумя атомами, использовавшиеся в квантово-химических расчетах. Из этой расчетной энергии, энергии взаимодействия иглы с кремниевой поверхностью и с поверхностным атомом кислорода можно определить разность в электроотрицательности данного атома кислорода и кремния. Jo Onoda et al. / Nature Communications, 2017
Это понятие позволяет делать предсказания о поведении и физических свойствах молекул. Например, у кислорода электроотрицательность выше, чем у водорода, поэтому в воде электронная плотность связей стянута к кислороду. Возникает поляризация в молекуле — отрицательный заряд на кислороде и положительный на водороде. В результате вода — полярный растворитель, высококипящий, способный растворять ионные соединения.
Понятие об электроотрицательности было известно еще во времена Авогадро и Берцелиуса, однако соответствующую количественную шкалу первым ввел Лайнус Полинг в 1932 году. Она была относительной — активным щелочным металлам (рубидию и цезию) были приписаны величины 0,7, фтору — 4. С помощью этой шкалы и уравнения Полинга можно оценить энергию связи меду двумя атомами. Сейчас есть абсолютные шкалы электроотрицательности, например, вводимые как среднее арифметическое между энергией ионизации (отрыва электрона от атома) и энергией сродства к электрону (присоединения электрона к нейтральному атому). Эти значения определяются из коллективных измерений свойств атомов.
Авторы новой работы предложили способ измерить электроотрицательность индивидуального атома в конкретном окружении напрямую, с помощью атомно-силового микроскопа. Последний представляет собой острую иглу, на конце которой может находиться всего лишь один атом и систему, которая позволяет очень точно определять положение этой иглы. С помощью кантилевера (иглы) микроскоп ощупывает поверхность образца. Благодаря высокой точности системы позиционирования система может изучать состояние и взаимодействие с иглой даже единичных атомов.
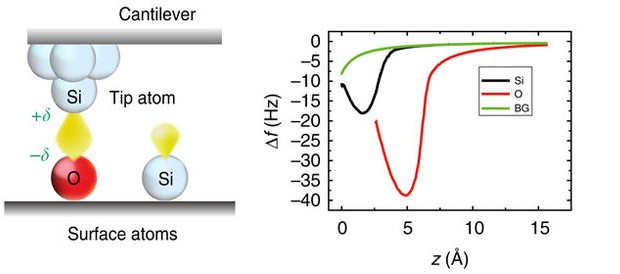 Схема эксперимента по измерению энергии связи между иглой и поверхностными атомами. Иглу подносят к поверхности, а затем медленно отрывают. При этом можно определить силу, с которой поверхность притягивает к себе иглу в зависимости от высоты по изменению характерной частоты колебаний иглы. Jo Onoda et al. / Nature Communications, 2017
Схема эксперимента по измерению энергии связи между иглой и поверхностными атомами. Иглу подносят к поверхности, а затем медленно отрывают. При этом можно определить силу, с которой поверхность притягивает к себе иглу в зависимости от высоты по изменению характерной частоты колебаний иглы. Jo Onoda et al. / Nature Communications, 2017
Исследователи создали набор кремниевых подложек, на которые были помещены отдельные атомы кислорода, германия, алюминия и олова. Для измерения электроотрицательности использовались чрезвычайно тонкие кремниевые иглы. С их помощью авторы могли сравнивать относительные величины энергии связи между кантилевером и атомом и между кантилевером и остальной поверхностью. Эти энергии с помощью уравнения Полинга и квантово-химического моделирования можно перевести в разности электроотрицательности между кремнием и изучаемыми атомами.
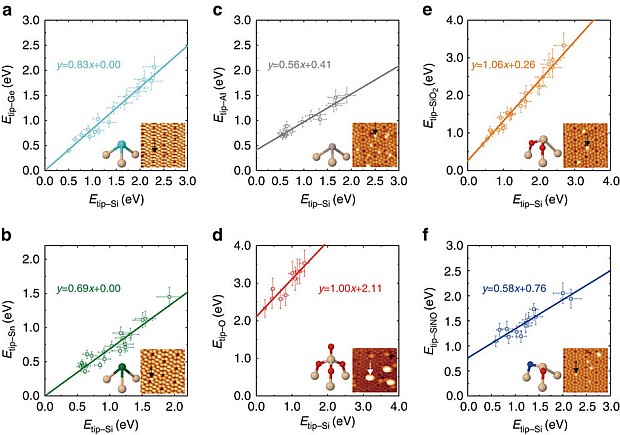 Результаты измерений энергии взаимодействия иглы с кремниевой частью подложки и с атомами германия, олова, алюминия, кислорода, кремния в окружении кислорода и кремния в окружении азота и кислорода. Наклон прямой определяет, положительна или отрицательна разность в электроотрицательности. На врезах ближайшее окружение исследуемого атома и скан поверхности. Jo Onoda et al. / Nature Communications, 2017
Результаты измерений энергии взаимодействия иглы с кремниевой частью подложки и с атомами германия, олова, алюминия, кислорода, кремния в окружении кислорода и кремния в окружении азота и кислорода. Наклон прямой определяет, положительна или отрицательна разность в электроотрицательности. На врезах ближайшее окружение исследуемого атома и скан поверхности. Jo Onoda et al. / Nature Communications, 2017
Интересно, что методика позволяет оценить то, как меняется электроотрицательность атома в зависимости от его окружения. Так, авторы показали, что электроотрицательность кремния, окруженного атомами кислорода (как в кварце, SiO2) больше, чем у кремния, окруженного атомами кремния. Это позволяет определять химические свойства отдельных атомов в наночастицах катализаторов, и, в перспективе, лучше моделировать их поведение.
Атомно-силовой микроскоп позволяет не только измерять свойства атомов (например, силы Ван-дер-Ваальса), но и манипулировать ими в пространстве, например, запуская химические реакции или просто перемещая атомы с места на место. Так, химики из исследовательской лаборатории IBM (Цюрих) использовали микроскоп для первого синтеза триангулена и молекул аринов.
Автор: Владимир Королёв
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России