Сделан существенный шаг к лечению болезни Альцгеймера
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Ученые Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ в сотрудничестве с коллегами из Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН и Исследовательским центром города Юлиха провели экспериментальное исследование перспективного лекарственного средства от нейродегенерации.
Результаты исследований, поддержанных РНФ (20–64–46027), опубликованы в Journal of Medicinal Chemistry и являются существенным шагом к решению застарелой проблемы всего человечества — лечению болезни Альцгеймера.
Процесс старения включает в себя различные возрастные нейродегенеративные заболевания, нарушающие сложную сеть метаболических и сигнальных путей. Болезнь Альцгеймера — самый распространенный в мире вид нейродегенеративного заболевания, которым ежегодно заболевает несколько миллионов человек, причем с возрастом вероятность развития этого вида деменции возрастает многократно. Сегодня уже более 50 миллионов человек во всем мире страдают от нейродегенерации, вызванной болезнью Альцгеймера, и ожидается, что из-за увеличения продолжительности жизни к 2050 году это число увеличится втрое.
Прошло уже 110 лет с тех пор, как болезнь была впервые описана Алоисом Альцгеймером как форма прогрессирующего нейродегенеративного и поведенческого расстройства. Несмотря на прогресс в науке и медицине, на обширные исследования и огромное количество информации, полученной по различным аспектам болезни, ее причины и молекулярные механизмы остаются в значительной степени неизвестными, и по-прежнему не существует эффективного метода лечения и профилактики. Сейчас мы знаем, что клинические проявления болезни Альцгеймера объясняются избирательной дегенерацией нейронов в участках коры головного мозга, ответственных за когнитивное восприятие и память.
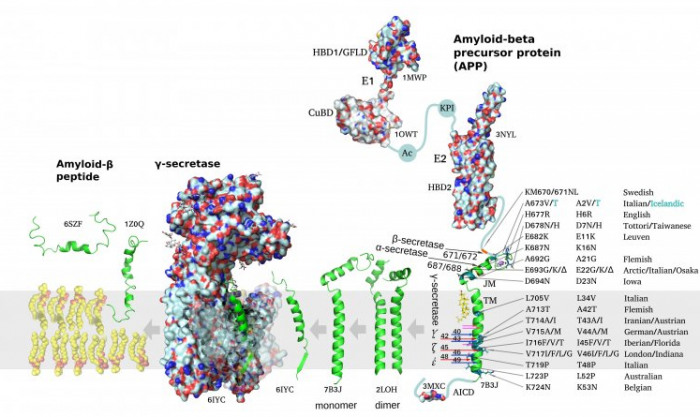 Рисунок 1. Схематическое изображение образования амилоидогенных пептидов Aβ (зеленым) построено с использованием экспериментально полученных структурных данных (номера структур по базе данных PDB указаны на схеме). Справа налево показан путь протеолитической деградации мембранного белка предшественника амилоида (amyloid precursor protein, АРР) с последующим образованием пептидов Aβ. Справа указаны наиболее распространенные семейные мутации, ассоциированные с ранним развитием болезни Альцгеймера (кроме A2T). Рисунок авторов статьи
Рисунок 1. Схематическое изображение образования амилоидогенных пептидов Aβ (зеленым) построено с использованием экспериментально полученных структурных данных (номера структур по базе данных PDB указаны на схеме). Справа налево показан путь протеолитической деградации мембранного белка предшественника амилоида (amyloid precursor protein, АРР) с последующим образованием пептидов Aβ. Справа указаны наиболее распространенные семейные мутации, ассоциированные с ранним развитием болезни Альцгеймера (кроме A2T). Рисунок авторов статьи
Известно, что в патогенезе болезни Альцгеймера задействованы различные пептиды и белки, в том числе амилоидогенные: прежде всего, бета-амилоидный пептид (Aβ), а также взаимодействующие с ним Тау-белок и прионный белок PrP.
Вне нервных клеток, в местах контакта нейронов, накапливается пептид Aβ, который собирается в протяженные упорядоченные структуры — фибриллы, формирующие так называемые амилоидные бляшки. В настоящий момент предложенные методы лечения основаны на разрушении внеклеточных отложений Aβ. Но это может привести к образованию гораздо более опасных малых сгруппированных вместе молекул пептида β-амилоида (олигомеров Aß), способных воздействовать на функцию белков, мембранных рецепторов и каналов, а также на нормальную работу внутриклеточных органелл, приводя к угнетению нейронов и клеточной смерти.
Биологическая роль пептида β-амилоида (Aβ) в норме (не при болезни) в значительной степени неизвестна. Тем не менее очень близкие формы пептида β-амилоида, отличающиеся на один или несколько аминокислотных остатков (изоформы Aβ) различной длины, встречаются у людей независимо от возраста и наличия проявлений болезни. Пептиды Aβ могут играть роль в сигнальных путях в головном мозге и, вероятно, имеют нейропротекторные свойства при низких концентрациях.
Все изоформы пептидов Aβ склонны к олигомеризации, и именно олигомеры играют решающую роль в патогенезе болезни Альцгеймера, оказывая токсическое действие на нейроны и их органеллы. Поэтому профессором Дитером Вильбольдом были разработаны так называемый D-энантиомерный пептид D3 и его производные для разборки и разрушения цитотоксических малых олигомеров Aβ. На данный момент одно из D3-подобных соединений находится в фазе II клинических испытаний.
 Рисунок 2. С использованием экспериментально полученных структурных данных представлено схематическое изображение действия пептида D3 (показан фиолетовым цветом) на CTFβ1–55 (мембрано-ассоциированный пептид в нижней части рисунка) с последующим образованием комплексов D3:Aβ1–42 (в левой верхней части рисунка, модели структур любезно предоставлены Dr. Jennifer Loschwitz) и ингибированием образования токсичных олигомеров Aβ (в правой верхней части рисунка). Рисунок авторов статьи
Рисунок 2. С использованием экспериментально полученных структурных данных представлено схематическое изображение действия пептида D3 (показан фиолетовым цветом) на CTFβ1–55 (мембрано-ассоциированный пептид в нижней части рисунка) с последующим образованием комплексов D3:Aβ1–42 (в левой верхней части рисунка, модели структур любезно предоставлены Dr. Jennifer Loschwitz) и ингибированием образования токсичных олигомеров Aβ (в правой верхней части рисунка). Рисунок авторов статьи
В результате плодотворного многолетнего сотрудничества между МФТИ и Исследовательским центром г. Юлиха (Forschungszentrum Jülich, FZJ) исследователи выяснили, как происходит взаимодействие пептидов на молекулярном уровне. Оказалось, что пептид D3, стабилизирующий мономер Aβ, динамически взаимодействует с прилегающей к мембране областью мембранного белка предшественника Aβ — CTFβ.
Эдуард Бочаров, ведущий исследователь, рассказал: «Мы использовали структурные данные высокого разрешения, экспериментально полученные с помощью ЯМР, как граничные условия для молекулярного моделирования. Исследование показало, что D3 нацелен на амилоидогенную область Aβ. Мы предполагаем, что тем самым он подавляет ранние стадии приобретения пептидом Aβ β-конформаций, характерных для малых токсичных олигомеров».
Современные методы позволяют изучать неупорядоченные белки (intrinsically disordered protein, IDP), но при этом некоторые эксперименты были проведены на грани чувствительности приборов. Например, сбор сигнала в экспериментах ЯМР (метод ядерного магнитного резонанса) занимал до трех дней. Эксперименты по определению константы диссоциации IDP-IDP комплекса заняли несколько месяцев, и были использованы все доступные команде методы.
Иван Охрименко, заместитель заведующего лабораторией старения и возрастных нейродегенеративных заболеваний МФТИ, добавил: «Важно, что D3 и Aβ являются неупорядоченными белками. При взаимодействии D3 и Aβ образуется подвижный, но устойчивый IDP-IDP комплекс, в котором конформации обоих полипептидов постоянно изменяются с изменением паттерна их межмолекулярных контактов».
В результате проведенных исследований впервые была экспериментально получена атомарная структура D-пептида, представителя нового перспективного класса лекарственных средств, в комплексе с прекурсором Aβ. Детальное понимание структурной динамики неупорядоченных белков позволяет разработать лекарственные средства для лечения и профилактики болезни Альцгеймера.
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России