Создана самая стабильная 3D-модель трансмембранного домена S-белка коронавируса
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Команда российских ученых с участием исследователей из МИЭМ НИУ ВШЭ представила 3D-модель трансмембранного (ТМ) домена S-белка вируса SARS-CoV-2. Ранее считалось, что ТМ-домен нужен только для закрепления S-белка вируса в его мембране, а все перестроения и слияние с клеткой-мишенью обеспечивают другие участки. Недавние исследования показывают, что ТМ-домен влияет на процесс передачи генетической информации, но точного понимания его роли еще нет. Ученые считают, что созданная модель поможет детальнее понять механизм работы вируса и применять эти знания для разработки нового типа лекарств.
Исследование опубликовано в журнале International Journal of Molecular Sciences.
Ученые называют вирусы неклеточной формой жизни или даже организмами на границе живого. Все потому, что у вирусов нет собственного обмена веществ и для существования им нужны клетки другого организма. Эта особенность отражается на строении: оболочка вирусов усеяна специальными белками, которые помогают распознать рецепторы клеток-мишеней и прикрепиться к ним. У коронавируса эту функцию в основном выполняют S-белки (spike), или «белки-шипы», которые на микрофотографиях и создают вокруг вирусов узнаваемую «солнечную корону».
S-белок (белок слияния, спайк-белок) коронавируса взаимодействует с ангиотензин-превращающим ферментом (АПФ) клетки-мишени, который регулирует у человека артериальное давление и водно-электролитный баланс. Так вирус обманывает защиту организма и связывается с клетками.
Для создания вакцин и лекарств важно понимать механизм действия вируса, поэтому внемембранные участки S-белка, участвующие в распознавании и захвате клеток, хорошо изучены. Но за кадром оставался трансмембранный домен S-белка — участок молекулярной структуры, расположенный внутри мембраны оболочки вируса. Команда российских ученых с участием биофизиков НИУ ВШЭ проанализировала особенности этого участка и представила 3D-модель трансмембранного домена S-белка.
Спайк-белок состоит из трех одинаковых полипептидных цепей, которые особым образом скомпонованы и соединены друг с другом. Когда вирус попадает в организм, внешний участок S-белка связывается с рецептором на поверхности клетки. Белки нашего организма — протеазы — разрезают белок и обнажают ранее скрытые участки. Структура S-белка меняется, он встраивается в мембрану клетки и, подобно тросам, подтягивает ее к себе. Благодаря этому мембраны сливаются, образуется канал, по которому вирусная РНК (генетический материал) проникает в клетку хозяина.
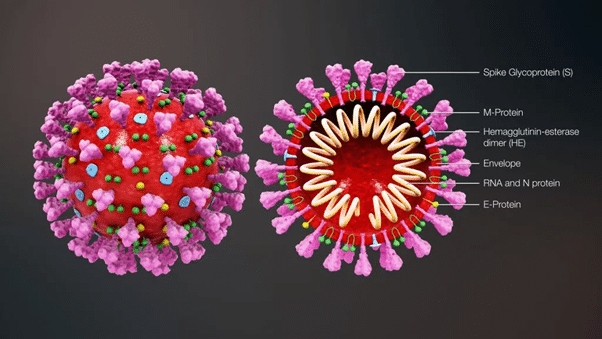 Структура коронавируса / ©Vet Union
Структура коронавируса / ©Vet Union
Внимание к тому, как в этих процессах участвует трансмембранный домен — небольшой участок спайк-белка, форма которого внешне напоминает пружинку, — ученые стали проявлять в период пандемии. Ранее считалось, что домен нужен только для закрепления S-белка в мембране вируса, и его подробно не изучали. Сейчас ученые предполагают, что особенности структуры ТМ-домена критическим образом влияют на механизм работы спайк-белка и нужно учитывать их в моделях. Однако, как отмечают авторы статьи, создать такую модель сложно.
«Экспериментальными методами тяжело воссоздать структуру белка, если в нем есть участки, связанные с мембраной. Как только вы извлекаете трансмембранный домен из его природного мембранного окружения, он теряет пространственную структуру, и уже нельзя понять, как именно молекула организована в своем функционально активном состоянии», — поясняет профессор департамента прикладной математики МИЭМ НИУ ВШЭ Роман Ефремов.
Чтобы решить этот вопрос, ученые использовали компьютерное моделирование. Алгоритм помогал подобрать из базы данных такие структуры тримеров альфа-спиралей белка, свойства мономеров которых были бы наиболее подходящими для оптимальной упаковки ТМ-домена. Сравнивали физико-химические свойства ТМ-пептидов, а также сходство между распределениями гидрофильных и гидрофобных свойств на поверхности белковых спиралей ТМ-домена. Затем модели скорректировали с учетом результатов разработанной авторами программы для предсказания димерной структуры ТМ-спиралей. Стабильность построенных моделей ТМ-домена S-белка подтвердили в расчетах его молекулярной динамики в явно заданном липидном бислое, имитирующем мембрану вируса.
«На сегодняшний день это единственная плотно упакованная, стабильная модель ТМ-домена S-белка. С помощью коллег из лабораторий Института биоорганической химии РАН мы будем рассматривать структурно-динамическое поведение ТМ-доменов уже в ходе экспериментов, — объясняет Роман Ефремов. — Это важно для понимания роли ТМ- и примембранных участков в процессе слияния и передачи генетической информации. Если мы это выясним с помощью моделей, то сможем эффективно разрабатывать средства борьбы с вирусами. Например, создавать молекулы, которые будут снижать скорость работы вируса, меняя характеристики взаимодействия с мембраной определенных областей спайк-белка. В результате он не будет так быстро распространяться и станет гораздо менее опасным».
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России