РНК-интерференция и фарма, или По Млечному пути: от нуклеотида к лекарству
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Открытие РНК-интерференции (RNA interference ― RNAi) существенно изменило наше понимание биологических процессов и способствовало созданию нового и мощного инструмента для биологических исследований. Технологии на основе РНК-интерференции становятся все более и более важной платформой для проведения исследований и изучения лекарственных средств, обладающих значительным потенциалом, что позволяет существенно расширить точки их приложения.

Не так давно многие известные фармацевтические производители приобрели или заключили соглашения о сотрудничестве с небольшими биотехнологическими компаниями для того, чтобы получить доступ к их технологиям на основе РНК-интерференции с целью последующего выведения на фармацевтический рынок лекарственных средств, полученных при помощи данных технологий. Так же, как и моноклональные антитела ранее, препараты, созданные на основе RNAi, представляют новые способы терапевтического воздействия, ныне провозглашающие о начале новой эры в медицине. Однако пройдет еще немало времени, прежде чем получившее Нобелевскую премию открытие получит распространенное применение в терапии самого широкого круга заболеваний.
Пионеры РНК-интерференции
Одними из первых ― еще в 2002 г., то есть за 5 лет до того, как учеными, открывшими РНК-интерференцию, была получена Нобелевская премия в области медицины или физиологии, ― технологию на основе РНК-интерференции для фундаментальных исследований начали использовать и оптимизировать ученые из американской фармацевтической компании «Merck&Co., Inc.». Их сфокусированность на транскрипционном анализе (профайлинге) экспрессии генов1, который представляется как платформа для разработки новых лекарственных средств, способствовала скорейшему принятию RNAi-технологий, предложивших новый и эффективный способ снизить in vitro активность того или иного гена, связанного с каким-либо заболеванием.
Среди нескольких факторов, способствовавших прогрессу RNAi-технологий и тому, чтобы они перекочевали из лабораторной пробирки исследователя в клиническую практику, считает доктор Алан Сачс (Alan Sachs), вице-президент, руководитель отдела РНК-терапии и молекулярного профайлинга (RNA Therapeutics and Molecular Profiling) компании «Merck Research Laboratories», подразделения «Merck&Co.», можно в первую очередь отметить окончание проекта «Геном человека» («Human Genome Project»; www.ornl.gov), который позволил создать короткие двухспиральные интерферирующие РНК (или малые интерферирующие РНК; от англ. small interfering RNA ― siRNA, также известные под названием silencing RNA2), обладающие способностью «выключать», «глушить» любой ген, то есть делать его «неактивным». Во-вторых, ученые выяснили, что многие из новых обнаруженных мишеней, которые удалось идентифицировать посредством экспрессии генов, а также посредством проведения экспериментов по РНК-интерференции в тканях клеточных культур, вероятнее всего, будут недоступны для воздействия низкомолекулярными препаратами (small-molecule drugs) или биологическими препаратам. Именно поэтому изобретение способа воздействия на эти мишени на уровне информационной РНК (иРНК; messenger RNA ― mRNA) еще более заинтересовало ученых. А приобретение «Merck&Co.» базирующейся в Сан-Франциско биотехнологической компании «Sirna Therapeutics Inc.» (www.sirna.com) в декабре 2006 г. дополнило возможности первой в основном исследовании РНК и предоставило необходимые технологии для создания RNAi-терапевтических средств.
С тех пор осуществляется систематическая, пошаговая стратегия комплексного внедрения RNAi-технологии на всех этапах разработки лекарственных средств, а также внедрение их в процесс исследования, дизайн которых мог бы позволить использовать весь богатый потенциал этой технологии (рисунок).
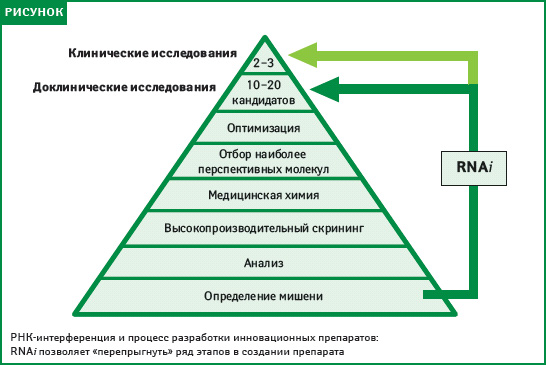
Цели этой стратегии ученые видят в том, чтобы (1) в ближайшей перспективе идентифицировать новые мишени для терапевтического воздействия; (2) сделать более вероятной успешность осуществления программ по созданию низкомолекулярных лекарств и биологических препаратов с задаваемыми на ранних стадиях их разработки свойствами; (3) создать надежную и широко применимую технологическую платформу, которая в долгосрочной перспективе позволит разработать лекарственные средства на основе РНК-интерференции для лечения широкого диапазона заболеваний.
Поиск новых мишеней
Открытие, сделанное по счастливой случайности и показавшее, что короткая двухспиральная РНК (siRNA) может использоваться для того, чтобы активизировать естественный механизм сайлесинга («выключения») генов, оказало большое влияние на фундаментальные исследования. RNAi-технология предоставила возможность специфично ингибировать экспрессию любого из генов без применения трудоемких методов, а также методов, требующих больших временных затрат. Однако на ранних этапах исследователи столкнулись с препятствиями в управлении генной активностью в клеточных культурах с применением синтетической siRNA. Например, создание библиотек (genome-scale libraries) генома siRNA потребовало разработки алгоритмов, которые могли бы предсказать последовательность каждого гена в геноме эффективных siRNA (Jackson A.L., Bartz S.R., Schelter J. et al., 2003).
К 2006 г. лабораторией Питера Линсли (Peter Linsley) совместно с «Rosetta Inpharmatics LLC.» (www.rii.com) был оптимизирован отбор последовательностей siRNA и изучены химические модификации структур их молекул, что минимизировало вероятность «промахов», неверных эффектов (off-target effects), а также способствовало повышению их эффективности (Jackson A.L., Burchard J., Schelter J. et al., 2006).
Наличие мишеней для воздействия siRNA в геноме мыши и человека, а также развитие автоматизированной и мощной системы скрининга тканей клеточных культур обеспечило возможность проведения исследований по «нокауту» (knockout) всего генома. Высокая производительность RNAi-скрининга быстро стала важной стратегией в анализе молекулярных цепочек (molecular pathways). Недавно опубликованные статьи описывают использование РНК-интерференции в скрининге всего генома ― от клеток млекопитающих до дрозофилы, ― с целью изучения разнообразных процессов, например таких, как передача сигналов белком Wnt3 (Sepp K.J., Hong P., Lizarraga S.B. et al., 2008; Tang W., Dodge M., Gundapaneni D. et al., 2008).
В фармацевтических исследовательских лабораториях скрининг с применением siRNA широко используется для определения, подтверждения и отбора новых терапевтических мишеней. В «Merck&Co.» активно применяется подобная технология, посредством которой идет работа над теми исследовательскими мишенями, в которых заинтересованы исследователи данной компании. Так, например, в исследованиях в области онкологии проводится экранирование всего генома с целью идентификации тех генов, воздействие на которые химиотерапевтическими средствами ослабит рост или выживание опухолевых клеток, но при этом данное лечение будет индифферентно в отношении здоровых клеток. Также siRNA используется в скрининге мишеней других заболеваний, в том числе метаболических нарушений, сердечно-сосудистых заболеваний и неврологических расстройств. Например, Джон Мажеркак (John Majercak) совместно с коллегами использовали данный подход для анализа метаболизма β-амилоида, который вовлечен в развитие болезни Альцгеймера (Majercak J., Ray W.J., Espeseth A. et al., 2006).
Благодаря последним достижениям в этой отрасли, в частности созданию высокопроизводительной модели скрининга, теперь можно систематически проводить параллельный «нокаут» тысяч комбинаций генов и в реальном времени исследовать фенотипические изменения, проходящие в небольшом количестве клеток. Это является также мощным средством анализа и развития интегративной геномики (integrative genomics), обладающей значительным потенциалом. Совместно с генетикой, геномикой и другими областями биологических знаний современный siRNA-скрининг может использоваться для выявления нарушений во взаимосвязях между генами, определять и подтверждать в пределах этих систем важные точки, связанные с процессами формирования заболевания (Schadt E.E., 2007). Осуществляются значительные инвестиции как в разработку автоматизированной технологии скрининга, так и в создание трудоемких биоинформационных инфраструктур, необходимых для того, чтобы детально изучать механизмы развития заболеваний, что также может привести к открытию новых мишеней для терапевтического воздействия при таких распространенных видах патологии, как рак, болезнь Альцгеймера, сахарный диабет, ожирение и атеросклероз.
Подтверждение правильности выбранных мишеней
Наиболее часто надежды, связываемые с изучением РНК-интерференции, фокусируются на перспективе создания лекарственных средств широкого терапевтического воздействия. При этом с помощью данной технологии ведется поиск специфических мишеней, на которые лекарственные средства воздействовали бы непосредственно. Здесь наиболее поучительна история разработки и изучения моноклональных антител. Ученые Сезар Мильштейн (Cesar Milstein) и Жорж Келер (George Köhler)4 изучали технику получения гибридомы5 в 1975 г., но только в 1990‑х годах лекарственные средства на основе моноклональных антител были одобрены для применения у пациентов с такими распространенными заболеваниями, как сердечно-сосудистые заболевания и рак. Однако к началу 1980‑х годов технология получения моноклональных антител уже являлась революционной практикой в иммунологии и патологии, способствующей улучшению терапии заболеваний и облегчающей решение вопросов, связанных с диагностикой и лечением. Пошаговая стратегия «Merck&Co.» по развитию РНК-интерференции включает также использование RNAi-технологии для получения ценной информации, которая будет способствовать правильному принятию решений на всех стадиях разработки лекарственных средств и повысит вероятность успеха в проведении традиционной терапии.
При проведении доклинических исследований RNAi-технология может быть применена на животных моделях для оценки физиологических эффектов «нокаутирования» генов специфических мишеней. В последнее время вирусные векторы (viral vectors)6, конститутивно экспрессирующие активные короткие РНК, образующие «шпильки» (short hairpin RNA, или small hairpin RNA ― shRNA), были введены в организм мышей с целью «нокаутировать» экспрессию множества генов-мишеней в естественных условиях, включая ген дистрофии Дюшенна (dystrophin gene) и гены печени (контролирующие глюконеогенез), вовлеченные в развитие сахарного диабета II типа (Ghahramani Seno M.M., Graham I.R., Athanasopoulos T. еt al., 2008; Ruiz R., Witting S.R., Saxena R. еt al., 2008). Ожидается, что результаты экспериментов по «нокауту» генов с использованием siRNA на других животных моделях (например таких как приматы) обеспечат дополнительную информацию, которая поможет принять решение, стоит ли продолжать искать новые мишени для воздействия на них низкомолекулярными лекарствами.
В клинических условиях путем разового или неоднократного введения пациенту оптимизированной siRNA можно будет установить биомаркеры (например уровень глюкозы крови или уровень холестерина липопротеинов низкой плотности), что позволит достаточно быстро ― за несколько дней или недель ― оценить физиологический эффект ингибирования мишени. И несмотря на то, что еще остаются некоторые нерешенные проблемы технического характера, исследования siRNA с участием человека могут начаться уже в ближайшем будущем. Получение подтверждения эффективности воздействия на выбранные при помощи РНК-интерференции мишени у пациентов будет способствовать облегчению принятия верного решения и в конечном итоге повысит вероятность успешного применения низкомолекулярных или биологических препаратов.
Измерение шансов на успех
Интерес к методам лечения, разработанным на основе RNAi-технологий, начался вскоре после открытия в 1980‑х годах ферментативно активных РНК, так называемых рибозимов (ribozymes)7, а также антисмысловых олигонуклеотидов. Перспектива разработки лекарств, которые были бы способны ингибировать активность того или иного гена на транскрипционном или посттранскрипционном уровне, привела к появлению множества гипотез и, как следствие, всей индустрии, использующей данные подходы. Более чем два десятилетия спустя 25 препаратов-кандидатов на основе антисмысловых РНК начали изучаться в ходе клинических исследований, однако только лишь один из них, продукт для применения в офтальмологии, был одобрен Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) для применения у пациентов (Sepp-Lorenzino L., Ruddy Mk., 2008). И ни одно средство на основе рибозимов не достигло успеха в разработке.
История развития терапевтических подходов на основе РНК с учетом нынешней заинтересованности РНК-интерференцией делает все более и более близкой перспективу создания лекарственных средств, в основе которых лежали бы данные технологии. И наряду со связанными с этими технологиями стратегиями важно постоянно не упускать из вида ряд нескольких важных вопросов ― доставку препарата к мишени, селективный отбор мишеней, а также определение характеристик безопасности, ― прежде чем мы сможем полностью понять, что нам обещает терапия, основанная на РНК-интерференции.
Доставка
Эффективная доставка ― единственный наибольший барьер к широкому внедрению терапевтических методов, основанных на использовании РНК-интерференции. «Голые» нуклеиновые кислоты (naked nucleic acid)8 ― даже те, которые были химически модифицированы с целью сделать их резистентными к деградации эндогенными нуклеазами, ― обладают коротким периодом полувыведения, очень быстро выводятся из организма. Как таковое введение препаратов для системного действия с незащищенными siRNA непрактично. В настоящее время главным подходом в преодолении проблем, связанных с коротким периодом полувыведения и низкой биодоступностью подобных препаратов, является их локальное введение. Так, самые перспективные среди кандидатов-препаратов вводятся непосредственно в орган-мишень, например в стекловидное тело глаза, или наносятся на слизистые оболочки, такие как эпителий дыхательных путей (посредством назального спрея или ингалятора).
Эффективное системное применение препаратов, полученных на основе РНК-интерференции, потребует развития специальных платформ для доставки действующих веществ. Они должны способствовать стабильности таких препаратов и их биодоступности, а также должны позволить молекулам достигать клеток-мишеней и непосредственно проникать в них. Одна из стратегий состоит в том, чтобы инкапсулировать siRNA внутрь липидных наночастиц (стелс-липосомы), хотя у этого подхода есть некоторые недостатки. Во-первых, липидные наночастицы не распределяются по всему организму, а накапливаются прежде всего в печени и селезенке. Кроме того, применение липидных наночастиц может быть связано с токсическими эффектами, которые значительно ограничат применение терапевтических доз препарата, что может стать препятствием к назначению терапевтических концентраций siRNA пациентам (Nguyen T., Menocal E.M., Harborth J., Fruehauf J.H., 2008). Наконец, применение препаратов на основе липидов или полимеров имеет определенные ограничения, прежде всего в разработке парентеральных форм. К тому же, несмотря на то, что применение подобных лекарственных средств вполне может подойти для лечения некоторых заболеваний, они не будут иметь коммерческой выгоды для биофармацевтической компании, а, следовательно, не станут использоваться для создания лекарств для лечения многих распространенных болезней, таких как гиперлипидемия, ожирение и диабет. Более того, доставка siRNA к любой из заданных клеток, тканей или органов (что часто называется адресной доставкой (targeted delivery)), по мнению некоторых ученых, может потребовать разработки различных подходов, каждый из которых будет необходимо оптимизировать для конкретного органа/клетки (Downward J., 2004).
Отбор мишеней
Вероятно, не все заболевания будут одинаково поддаваться терапии на основе РНК-интерференции, даже если технические достижения смогут учесть и обеспечить эффективную доставку молекул к нужным тканям или органам, ― siRNA значительно ослабляет экспрессию гена, однако не «выключает» его полностью, говорит доктор А. Сачс. Для некоторых видов патологии, таких как рак, «выключение» активности специфических генов может быть желательным или даже необходимым. Для лечения же других заболеваний этот подход может оказаться не совсем достаточным, если это касается, например, воздействия на механизм развития заболевания. Выбор верных, оправданных мишеней для воздействия такими методами потребует тщательного доклинического и раннего клинического изучения, чтобы представить биологические и клинические доказательства обоснованности такого подхода.
Необходимым и важным является также рассмотрение вопроса о том, имеет ли лечение, основанное на РНК-интерференции, существенные клинические выгоды в сравнении или в комбинации с имеющимися в настоящее время подходами и лекарственными средствами. До сих пор принятие решения о разработке того или иного препарата велось прежде всего с учетом того, насколько легко можно обеспечить локальное поступление препарата, разработанного на основе RNAi-технологии. Сегодня же компании свою цель видят в том, чтобы определить и разработать методы дифференцированной РНК-интерферентной терапии, которая значительно улучшит состояние пациентов с общими заболеваниями, когда будет обеспечена доставка как одной siRNA, так и их комбинации, или же введение комбинации siRNA с другими средствами, например низкомолекулярными препаратами.
Вопросы безопасности
Остается несколько вопросов, которые связаны с безопасностью использования препаратов на основе технологии РНК-интерференции. Например, как и в случае с привычными для нас лекарствами, сложно предугадать, как ингибирование одной специфической мишени скажется на активности других генов.
Другое, что вызывает потенциальную обеспокоенность ученых, ― результаты наблюдений, показывающие, что введение нуклеиновых кислот в кровоток может стать триггером (то есть пусковым механизмом) естественного иммунного ответа, приводящего к активации цитокинов, таких как интерферон и фактор некроза опухоли. Развитие этого эффекта можно сдержать или смягчить посредством химической модификации молекулы siRNA, хотя, вероятнее всего, в каждом отдельном случае это не будет обладать одинаковой эффективностью. Понимание профиля токсичности системной терапии на основе РНК-интерференции, кроме того, будет осложняться также и наложением побочных эффектов стелс-липосомы или другого переносчика. Так, например, липидные наночастицы могут активизировать иммунный ответ и систему комплемента (Sepp-Lorenzino L., Ruddy M.K., 2008; www.nature.com). Поэтому перед учеными будет также стоять задача разобраться и затем минимизировать профили токсичности продуктов, полученных на основе РНК-интерференции.
Для того чтобы решить каждую из этих проблем, применяется экспертиза химии РНК и ее модификации, проводится экспертиза молекулярных особенностей, идентификация биомаркеров, доклиническая оценка безопасности, экспериментальные медицинские исследования и изучение дизайна клинических испытаний. Например, используется микроматричный профайлинг (microarray profiling) для оценки внецелевых эффектов (off-target effects), которые может оказывать siRNA в клетках человека, а также идентифицируются биомаркеры, которые в конечном счете будут использованы в клинических исследованиях с участием человека при выявлении различных потенциальных проблем на ранних этапах изучения. А в доклинические токсикологические программы и I фазу клинического исследования предполагается включить рутинное измерение активности цитокинов и комплемента для оценки возможных эффектов, оказываемых препаратами-кандидатами на иммунную систему. Кроме того, исследователи рассчитывают использовать плазменные биомаркеры и результаты исследования молекулярного профайлинга для того, чтобы понять эффекты siRNA на уровне тканей и найти отличия между токсичностью, вызываемой олигонуклеотидами (oligonucleotide-related toxicities), и токсичностью, связанной непосредственно с переносчиком (vehicle-related toxicities).
Вместе с тем технология на основе РНК-интерференции является еще молодой областью, и необходимо проведение тщательной работы, чтобы на ее основе можно было создать жизнеспособное предприятие с перспективой долгосрочного развития. Успешный запуск RNAi-платформы по созданию лекарственных средств потребует также значительных долгосрочных инвестиций и, вероятно, будет характеризоваться пошаговым прогрессом, а не однократным прорывом, который решит сразу все проблемы. Однако как только будут преодолены все начальные препятствия, перед исследователями возникнет ряд уже ранее знакомых вопросов, например, как усовершенствовать те из молекул, которые оказались эффективными.
Лучше и больше, и лучше
Находящиеся на самом пике технологии, основанные на феномене РНК-интерференции, сегодня уже широко используется биотехнологическими компаниями не только для решения описанных выше качественных, но и количественных задач.
Так, биотехнологическая компания «Alnylam Pharmaceuticals Inc.», базирующаяся в Кембридже (штат Массачусетс, США), уже использует технологию РНК-интерференции в своих исследованиях по разработке новых препаратов. В ней используются короткие двухцепочечные фрагменты РНК (siRNA) не только для снижения активности определенных генов, связанных с заболеваниями, но и производства большего количества необходимых белков. В настоящее время «Alnylam Pharmaceuticals» планирует использовать эту технологию для того, чтобы наладить производство лекарственных средств на основе протеинов ― препаратов моноклональных антител, вакцин и других биологических продуктов. А относительно недавно, 12 ноября 2009 г., компания объявила о создании нового предприятия, названного «Alnylam Biotherapeutics», которое будет развивать данную технологию и сотрудничать с другими биофармацевтическими компаниями, заинтересованными в применении подхода, направленного на производство препаратов на основе клеточных культур (www.alnylam.com).
По замечанию Джона Марагэнора (John Maraganore), руководителя «Alnylam Pharmaceuticals», компания секвенировала (расшифровала последовательность) геном яичников китайского хомяка (Chinese hamster ovary ― CHO), наиболее широко используемого для синтеза рекомбинантных белков после предварительной амплификации (образования дополнительных копий участков хромосомной ДНК) генов, введенных в клетки. Используя геном, «Alnylam Pharmaceuticals» проводит дизайн siRNA, при помощи которых удается увеличить продолжительность жизни клеток, а значит потенциально увеличить количество синтезируемого белка для производства биологических препаратов. Например, подавление экспрессии двух генов, регулирующих механизм клеточной смерти, увеличивало продолжительность жизни клеток примерно на 40%, а воздействие на ген, участвующий в молочнокислом метаболизме, — на 60%. По словам руководителя компании, технология РНК-интерференции может быть использована для того, чтобы изменить клетку так, чтобы она жила дольше и чаще делилась, а, следовательно, производила большее количество необходимых пептидов.
Такой подход уже не нов и имеет прецеденты. Так, группа исследователей из Сингапурского биопроцессингового технологического института (Bioprocessing Technology Institute) смогла продемонстрировать, что с помощью РНК-интерференции можно более чем в два раза увеличить количество продуцируемых протеинов в культуре клеток СНО. По словам одного из руководителей этого проекта, доктора Живея Сонга (Zhiwei Song), сейчас главная задача заключается в разработке методики применения РНК-интерференции в рамках масштабных клеточных культур, например в биореакторах.
Возможность повысить производительность клеточной культуры без изменения ее качественного состава, считает Дерек Эллисон (Derek Ellison), главный операционный директор британской контрактной биотехнологической компании «Eden Biodesign Ltd.», конечно же, представляет огромный интерес для биотехнологической промышленности. Однако, прежде всего, «Alnylam» должна бы доказать, что РНК-интерференция не привносит примесей или не изменяет качества синтезируемых таким образом биопрепаратов.
Су-Чин Ву (Suh-Chin Wu), биоинженер в области клеточных культур из Национального университета Цин Хуа (National Tsing Hua University) в Тайване, недавно написавший обзор о применении РНК-интерференции в клетках СНО, считает, что с лекарственными средствами, полученными при помощи РНК-интерференции, не будут связаны проблемы качества и безопасности. Такие биопрепараты, которые в настоящее время проходят различные этапы финальных фаз клинических исследований, не продемонстрировали у пациентов каких-либо серьезных побочных эффектов. Так, введение siRNA в клеточную культуру не должно представлять впоследствии угрозы для здоровья или повлечь за собой какие-либо проблемы с одобрением таких препаратов со стороны регуляторных органов, говорит он.
Однако не все верят в успешность данной технологии. И даже если она окажется действенной, то не будет финансово выгодной, ― так считает Тиллман Гернгросс (Tillman Gerngross), биоинженер из Дартмутского колледжа (Dartmouth College) в Ганновере, Нью-Хэмпшир, США. Расходы на производство составляют лишь небольшую долю общей стоимости препарата. Поэтому перспективней работать в направлении улучшения качества и эффективности биопрепаратов, а не наращивания количественного производства, считает он.
Дорога в будущее
RNAi-технология ― высокопотенциальный инструмент, способный произвести революцию во всем, что касается открытия и разработки лекарственных средств: от просто идентификации новых мишеней и доказательства обоснованности их выбора до получения позитивных результатов и подтверждения их справедливости на более ранних этапах, а также создания новых способов терапевтического воздействия. Потенциальные выгоды сложно переоценить. Они включают как существенное сжатие графиков разработки лекарственного средства (см. рисунок), так и разработку методов терапии заболеваний, которые ранее не поддавались лечению. Вместе с тем остается много открытых вопросов. Решение сложных задач и в конечном счете — полное понимание перспектив, которые несет в себе РНК-интерференция, потребует проницательности, упорства, дисциплины и систематического применения всех научных инноваций, а также разработки новейших средств оценки лекарственных средств, чтобы все это вместе повлияло на новую технологию.
Валерий Юдин по материалам
www.scripnews.com; www.nature.com;
www.pnas.org; www.plosgenetics.org;
www.bmj.com; www.hmg.oxfordjournals.org
Коллаж Ирины Соболевой,
идея Валерия Юдина;
использованы иллюстрации
© Isselee/Dreamstime/Dreamstock,
© Y0jik/Dreamstime/Dreamstock,
© Alekss/Dreamstime/Dreamstock
1Процесс, в котором наследственная информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт — РНК или белок. Экспрессия генов может регулироваться на всех стадиях процесса: и во время транскрипции, и во время трансляции, и на стадии посттрансляционных модификаций белков.
2Silencing (англ.) ― заглушать.
3Белок Wnt ― универсальный регулятор индивидуального развития животных, придает полярность и способность к направленному движению не только клеткам развивающегося эмбриона или регенерирующей конечности, но и раковым клеткам.
4Оба ученых в 1984 г. стали лауреатами Нобелевской премии по физиологии или медицине «За теории относительно специфичности в развитии и контроле иммунной системы и открытие принципа продукции моноклональных антител». Ими была разработана техника получения моноклональных антител (nobelprize.org).
5Гибридо́ма — гибридная клеточная линия, полученная в результате слияния клеток двух видов: способных к образованию антител B-лимфоцитов, полученных из селезенки иммунизированной мыши, и раковых клеток миеломы. Слияние клеток производится с помощью нарушающего мембраны агента, такого как полиэтиленгликоль или вирус Сендай. Поскольку раковые клетки миеломы «бессмертны», то есть способны делиться большое количество раз, после слияния и соответствующей селекции гибридома, производящая моноклональные антитела против антигена, может поддерживаться долгое время.
6Методика генотерапии, основанная на доставке в пораженные клетки больного терапевтических генов с помощью вирусов.
7Рибози́м (сокращение от «рибонуклеиновая кислота» и «энзим»), также называемая ферментативной РНК или каталитической РНК, — это молекула РНК, обладающая каталитическим действием. Многие рибозимы естественного происхождения катализируют расщепление самих себя или других молекул РНК, кроме того, образование пептидной связи в белках происходит при помощи РНК рибосомы. В рамках исследований, посвященных происхождению жизни, удалось создать искусственные рибозимы типа РНК-полимеразы, способные при определенных условиях катализировать свою собственную сборку.
8«Голые» нуклеиновые кислоты (naked nucleic acid) ― система переноса функциональных генов без участия вирусов, при котором плазмидная ДНК может быть непосредственно трансфицирована в клетки с помощью прямых инъекций или введена с помощью так называемого «генного пистолета», выстреливающего микрочастицы из золота/вольфрама с нанесенной на них ДНК (Wolff, J.A., Malone, R.W., Williams P. et al., 1990; Cheng L., Ziegelhoffer P.R. and Yang N.S., 1993).
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России